क्या आपने कभी सोचा है कि जब आप चीनी को चाय में मिलाते हैं तो वह कहाँ गायब हो जाती है? या जब नमक समुद्री पानी में घुला होता है तो पानी का स्वाद नमकीन क्यों हो जाता है? ये सभी घटनाएँ विलयन (Solutions) की अद्भुत दुनिया का हिस्सा हैं।
रोजमर्रा के जीवन में हम अनगिनत विलयनों से घिरे रहते हैं – हमारे शरीर में बहने वाला खून एक जटिल विलयन है, हमारे द्वारा पीया जाने वाला पानी विभिन्न खनिजों का विलयन है, और यहाँ तक कि हमारे फेफड़ों में मौजूद हवा भी गैसों का विलयन है। फार्मास्यूटिकल उद्योग में दवाओं का निर्माण, खाद्य प्रसंस्करण, पेट्रोकेमिकल्स, और यहाँ तक कि पर्यावरण संरक्षण – सभी क्षेत्रों में विलयन की समझ महत्वपूर्ण है।
CBSE कक्षा 12 की रसायन विज्ञान की यह यूनिट न केवल आपकी बोर्ड परीक्षा के लिए महत्वपूर्ण है, बल्कि JEE और NEET जैसी प्रतियोगी परीक्षाओं में भी इसका विशेष महत्व है। इस अध्याय से आमतौर पर 6-8 अंकों के प्रश्न आते हैं।
सीखने का उद्देश्य (Learning Objectives)
इस अध्ययन गाइड को पूरा करने के बाद आप सक्षम होंगे:
- विलयन की विभिन्न प्रकारों को समझना और वर्गीकृत करना – द्रव्य की भौतिक अवस्था और घुलनशीलता के आधार पर
- सांद्रता की विभिन्न इकाइयों में परस्पर रूपांतरण करना – मोलरता, मोललता, मोल प्रभाज आदि
- राउल्ट के नियम और इसके अनुप्रयोगों को समझना – आदर्श और अनादर्श विलयनों के संदर्भ में
- संयोजी गुणधर्मों की गणना और व्याख्या करना – वाष्प दाब अवनमन, क्वथनांक वृद्धि, हिमांक अवनमन, परासरण दाब
- वैंट हॉफ कारक की भूमिका समझना – वियोजन और संयोग के संदर्भ में
- व्यावहारिक समस्याओं का समाधान करना – संख्यात्मक प्रश्नों से लेकर अवधारणात्मक प्रश्नों तक
विलयन का परिचय (Introduction to Solutions)
विलयन की परिभाषा (Definition of Solutions)
विलयन दो या दो से अधिक घटकों का एक समांगी मिश्रण है जिसमें सभी घटक आणविक स्तर पर समान रूप से वितरित होते हैं। सरल शब्दों में, जब एक पदार्थ दूसरे पदार्थ में पूरी तरह घुल जाता है और एक समान मिश्रण बनाता है, तो उसे विलयन कहते हैं।
उदाहरण: नमक का पानी में घुलना, चीनी का पानी में घुलना, अल्कोहल का पानी में मिलना।
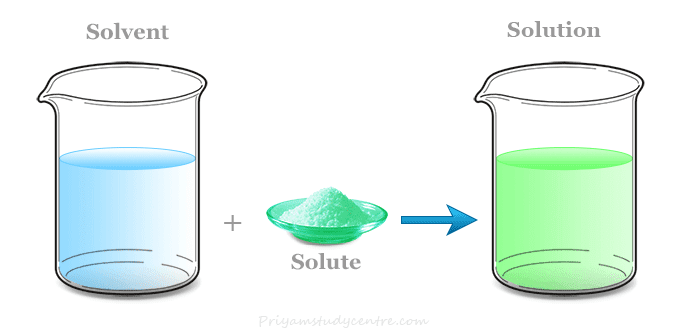
विलयन के घटक:
- विलायक (Solvent): वह घटक जो अधिक मात्रा में होता है और दूसरे घटकों को घोलता है
- विलेय (Solute): वह घटक जो कम मात्रा में होता है और विलायक में घुलता है
ऐतिहासिक संदर्भ: विलयन की आधुनिक अवधारणा का विकास 19वीं सदी में फ्रांसिसी रसायनज्ञ फ्रांकोइस-मैरी राउल्ट और जैकोबस हेनरिकस वैंट हॉफ के कार्यों से हुआ।
विलयन के प्रकार (Types of Solutions)
भौतिक अवस्था के आधार पर वर्गीकरण (Classification Based on Physical State)
1. ठोस विलयन (Solid Solutions)
- ठोस में ठोस: मिश्र धातुएँ (Alloys) जैसे पीतल (Cu + Zn), कांस्य (Cu + Sn)
- द्रव में ठोस: हाइड्रोजन का पैलेडियम में विलयन
- गैस में ठोस: कैंफर की वाष्प का हवा में विलयन
2. द्रव विलयन (Liquid Solutions)
- ठोस में द्रव: सोडियम का तरल अमोनिया में विलयन
- द्रव में द्रव: एथिल अल्कोहल का पानी में विलयन
- गैस में द्रव: हाइड्रोजन क्लोराइड का पानी में विलयन (HCl)
3. गैसीय विलयन (Gaseous Solutions)
- ठोस में गैस: आयोडीन वाष्प का हवा में विलयन
- द्रव में गैस: ऑक्सीजन का पानी में विलयन (मछलियों के लिए आवश्यक)
- गैस में गैस: वायु (N₂, O₂, CO₂ आदि का मिश्रण)
घुलनशीलता के आधार पर वर्गीकरण (Classification Based on Solubility)
1. अतिसंतृप्त विलयन (Supersaturated Solution)
ऐसा विलयन जिसमें विलेय की मात्रा उस तापमान पर सामान्य घुलनशीलता से अधिक होती है।
उदाहरण: सोडियम एसीटेट का गर्म पानी में विलयन जो ठंडा होने पर अतिसंतृप्त हो जाता है।
2. संतृप्त विलयन (Saturated Solution)
ऐसा विलयन जिसमें निश्चित तापमान पर अधिकतम मात्रा में विलेय घुला हो।
3. असंतृप्त विलयन (Unsaturated Solution)
ऐसा विलयन जिसमें निश्चित तापमान पर और भी विलेय घोला जा सकता है।
रसायन जाँच: यदि 25°C पर 100g पानी में 36g NaCl घुल सकता है, तो 25g NaCl को 100g पानी में घोलने पर किस प्रकार का विलयन बनेगा?
सांद्रता की इकाइयाँ (Concentration Units)
सांद्रता बताती है कि विलयन में विलेय की कितनी मात्रा मौजूद है। यह विलयन के गुणधर्मों को निर्धारित करने में महत्वपूर्ण भूमिका निभाती है।
1. द्रव्यमान प्रतिशत (Mass Percentage)
सूत्र: द्रव्यमान प्रतिशत = (विलेय का द्रव्यमान / विलयन का कुल द्रव्यमान) × 100
उदाहरण: 5g NaCl को 95g पानी में घोलने पर:
द्रव्यमान प्रतिशत = (5/100) × 100 = 5%
वास्तविक जीवन में रसायन: दवाओं में एथिल अल्कोहल की मात्रा, खाद्य पदार्थों में चीनी की मात्रा आदि।
2. आयतन प्रतिशत (Volume Percentage)
सूत्र: आयतन प्रतिशत = (विलेय का आयतन / विलयन का कुल आयतन) × 100
उदाहरण: 40% एथिल अल्कोहल का मतलब है 100 mL विलयन में 40 mL एथिल अल्कोहल है।
3. द्रव्यमान के आधार पर आयतन (Mass by Volume)
सूत्र: (W/V)% = (विलेय का द्रव्यमान (g) / विलयन का आयतन (mL)) × 100
4. मोलरता (Molarity – M)
परिभाषा: विलयन के एक लीटर में घुले हुए विलेय के मोलों की संख्या।
सूत्र: M = विलेय के मोल / विलयन का आयतन (L)
महत्वपूर्ण बिंदु: मोलरता तापमान पर निर्भर करती है क्योंकि आयतन तापमान के साथ बदलता है।
संख्यात्मक उदाहरण:
0.5M NaOH विलयन तैयार करने के लिए 250 mL विलयन में कितना NaOH चाहिए?
हल:
मोल = M × V(L) = 0.5 × 0.25 = 0.125 mol
NaOH का द्रव्यमान = 0.125 × 40 = 5g
5. मोललता (Molality – m)
परिभाषा: विलायक के 1000g में घुले हुए विलेय के मोलों की संख्या।
सूत्र: m = विलेय के मोल / विलायक का द्रव्यमान (kg)
महत्वपूर्ण लाभ: मोललता तापमान पर निर्भर नहीं करती है।
संख्यात्मक उदाहरण:
2 molal NaCl विलयन में 500g पानी में कितना NaCl घुला है?
हल:
विलेय के मोल = 2 × 0.5 = 1 mol
NaCl का द्रव्यमान = 1 × 58.5 = 58.5g
6. मोल प्रभाज (Mole Fraction)
परिभाषा: विलयन में किसी घटक के मोलों का कुल मोलों से अनुपात।
सूत्र:
- XA = nA / (nA + nB)
- XA + XB = 1
विशेष नोट: मोल प्रभाज इकाईरहित होता है।
7. नॉर्मलता (Normality – N)
परिभाषा: विलयन के एक लीटर में घुले हुए विलेय के ग्राम तुल्यांकों की संख्या।
सूत्र: N = ग्राम तुल्यांक / विलयन का आयतन (L)
संबंध: N = M × वैलेंसी या एसिडिटी/बेसिसिटी
सामान्य त्रुटि: छात्र अक्सर मोलरता और मोललता में भ्रम करते हैं। याद रखें: मोलरता में आयतन (L) और मोललता में द्रव्यमान (kg) का उपयोग होता है।
राउल्ट का नियम (Raoult’s Law)
नियम का कथन (Statement of the Law)
“निश्चित तापमान पर, किसी विलयन में विलायक का आंशिक वाष्प दाब, विलायक के मोल प्रभाज और शुद्ध विलायक के वाष्प दाब के गुणनफल के बराबर होता है।”
गणितीय रूप: PA = XA × P°A
जहाँ:
- PA = विलयन में A का आंशिक वाष्प दाब
- XA = A का मोल प्रभाज
- P°A = शुद्ध A का वाष्प दाब
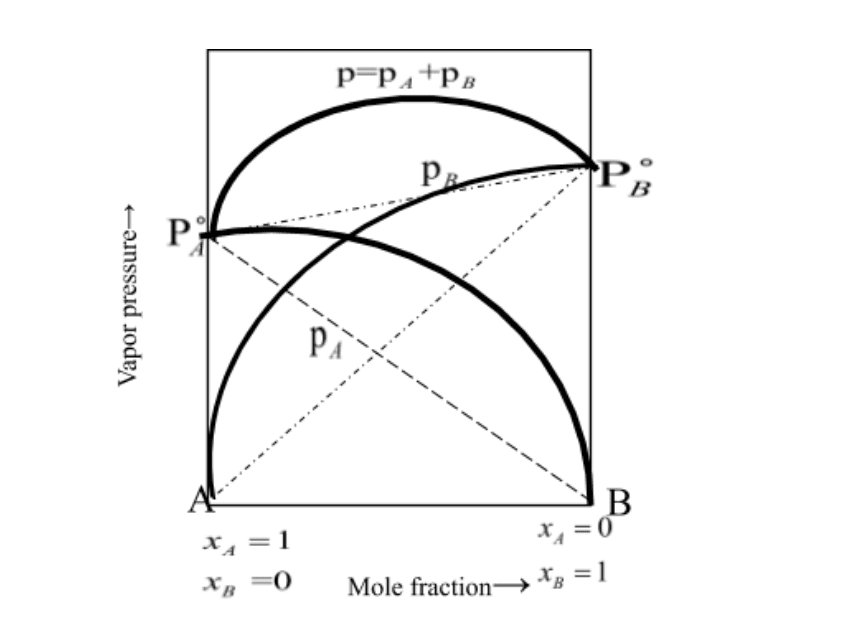
पूर्ण विलयन के लिए राउल्ट का नियम (Raoult’s Law for Complete Solution)
द्विघटकीय विलयन के लिए:
Ptotal = PA + PB = XA × P°A + XB × P°B
ऐतिहासिक संदर्भ: फ्रांसिसी रसायनज्ञ फ्रांकोइस-मैरी राउल्ट ने 1887 में इस नियम की खोज की।
वाष्प दाब का अवनमन (Lowering of Vapour Pressure)
जब किसी वाष्पशील विलायक में अवाष्पशील विलेय मिलाया जाता है:
ΔP = P°A – PA = P°A × XB
जहाँ XB विलेय का मोल प्रभाज है।
संख्यात्मक उदाहरण:
25°C पर शुद्ध पानी का वाष्प दाब 23.8 mmHg है। यदि 18g ग्लूकोज को 90g पानी में घोला जाए तो वाष्प दाब का अवनमन ज्ञात करें।
हल:
पानी के मोल = 90/18 = 5 mol
ग्लूकोज के मोल = 18/180 = 0.1 mol
कुल मोल = 5.1 mol
ग्लूकोज का मोल प्रभाज = 0.1/5.1 = 0.0196
ΔP = 23.8 × 0.0196 = 0.467 mmHg
आदर्श और अनादर्श विलयन (Ideal and Non-ideal Solutions)
आदर्श विलयन (Ideal Solutions)
परिभाषा: वे विलयन जो सभी सांद्रताओं पर राउल्ट के नियम का पालन करते हैं।
आदर्श विलयन की विशेषताएँ:
- ΔHmixing = 0 (मिश्रण की एन्थैल्पी शून्य)
- ΔVmixing = 0 (मिश्रण का आयतन परिवर्तन शून्य)
- A-A, B-B, और A-B के बीच समान अंतराणविक बल
उदाहरण: बेंजीन-टॉल्यून, n-हेक्सेन-n-हेप्टेन
अनादर्श विलयन (Non-ideal Solutions)
परिभाषा: वे विलयन जो राउल्ट के नियम से विचलन दिखाते हैं।
धनात्मक विचलन (Positive Deviation)
- स्थिति: PA > XA × P°A और PB > XB × P°B
- कारण: A-B के बीच कमजोर बल, A-A या B-B से कम
- उदाहरण: एथिल अल्कोहल-पानी, एथिल अल्कोहल-साइक्लोहेक्सेन
- ΔHmixing > 0 (ऊष्माशोषी प्रक्रिया)
ऋणात्मक विचलन (Negative Deviation)
- स्थिति: PA < XA × P°A और PB < XB × P°B
- कारण: A-B के बीच मजबूत बल, A-A या B-B से अधिक
- उदाहरण: HCl-पानी, HNO₃-पानी
- ΔHmixing < 0 (ऊष्माक्षेपी प्रक्रिया)
प्रक्रिया विश्लेषण: हाइड्रोजन बंधन का निर्माण
- HF + H₂O → H₂F⁺ + OH⁻
- नए हाइड्रोजन बंधन बनते हैं
- अधिक स्थायी संरचना
- वाष्प दाब में कमी
संयोजी गुणधर्म (Colligative Properties)
संयोजी गुणधर्म वे गुण हैं जो विलेय कणों की संख्या पर निर्भर करते हैं, उनकी प्रकृति पर नहीं। ये चार मुख्य प्रकार के होते हैं:
1. वाष्प दाब का अवनमन (Lowering of Vapour Pressure)
सिद्धांत: अवाष्पशील विलेय मिलाने पर विलायक का वाष्प दाब कम हो जाता है।
सूत्र: ΔP/P° = XB = nB/(nA + nB)
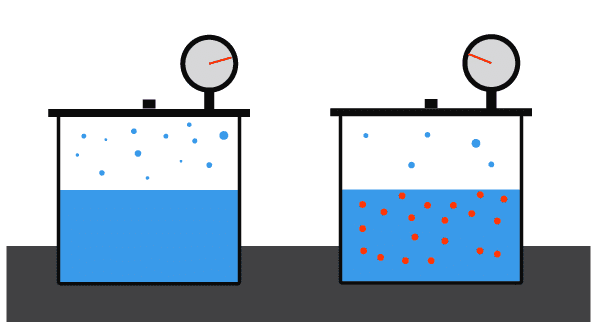
व्यावहारिक अनुप्रयोग:
- कार के रेडिएटर में एथिलीन ग्लाइकॉल मिलाना
- समुद्री जल का वाष्पीकरण धीमा होना
2. क्वथनांक की वृद्धि (Elevation of Boiling Point)
परिभाषा: विलयन का क्वथनांक शुद्ध विलायक के क्वथनांक से अधिक होता है।
सूत्र: ΔTb = Kb × m
जहाँ:
- ΔTb = क्वथनांक वृद्धि
- Kb = क्वथनांक स्थिरांक (विलायक का गुण)
- m = मोललता
विभिन्न विलायकों के लिए Kb मान:
- पानी: 0.512 K kg mol⁻¹
- बेंजीन: 2.53 K kg mol⁻¹
- एथिल अल्कोहल: 1.22 K kg mol⁻¹
संख्यात्मक उदाहरण:
1 molal ग्लूकोज विलयन का क्वथनांक ज्ञात करें।
हल:
ΔTb = 0.512 × 1 = 0.512 K
नया क्वथनांक = 100 + 0.512 = 100.512°C
वास्तविक जीवन में रसायन: खाना पकाते समय नमक मिलाने से पानी देर से उबलता है।
3. हिमांक का अवनमन (Depression of Freezing Point)
परिभाषा: विलयन का हिमांक शुद्ध विलायक के हिमांक से कम होता है।
सूत्र: ΔTf = Kf × m
जहाँ:
- ΔTf = हिमांक अवनमन
- Kf = हिमांक स्थिरांक
- m = मोललता
विभिन्न विलायकों के लिए Kf मान:
- पानी: 1.86 K kg mol⁻¹
- बेंजीन: 5.12 K kg mol⁻¹
- एसिटिक अम्ल: 3.90 K kg mol⁻¹
व्यावहारिक अनुप्रयोग:
- सर्दियों में सड़कों पर नमक छिड़कना
- कार के रेडिएटर में एंटी-फ्रीज़ मिलाना
- आइसक्रीम बनाने में नमक का प्रयोग
चित्र डालें: हिमांक अवनमन की प्रक्रिया दिखाने वाला फेज डायग्राम जहाँ ठोस-द्रव संतुलन रेखा नीचे की ओर विस्थापित हो।
4. परासरण दाब (Osmotic Pressure)
परिभाषा: वह दाब जो विलयन पर लगाना पड़ता है ताकि अर्धपारगम्य झिल्ली के द्वारा विलायक का प्रवाह रुक जाए।
वैंट हॉफ समीकरण: π = nRT/V = CRT
जहाँ:
- π = परासरण दाब
- n = विलेय के मोल
- R = गैस स्थिरांक (0.0821 L atm K⁻¹ mol⁻¹)
- T = तापमान (K)
- V = विलयन का आयतन (L)
- C = मोलर सांद्रता
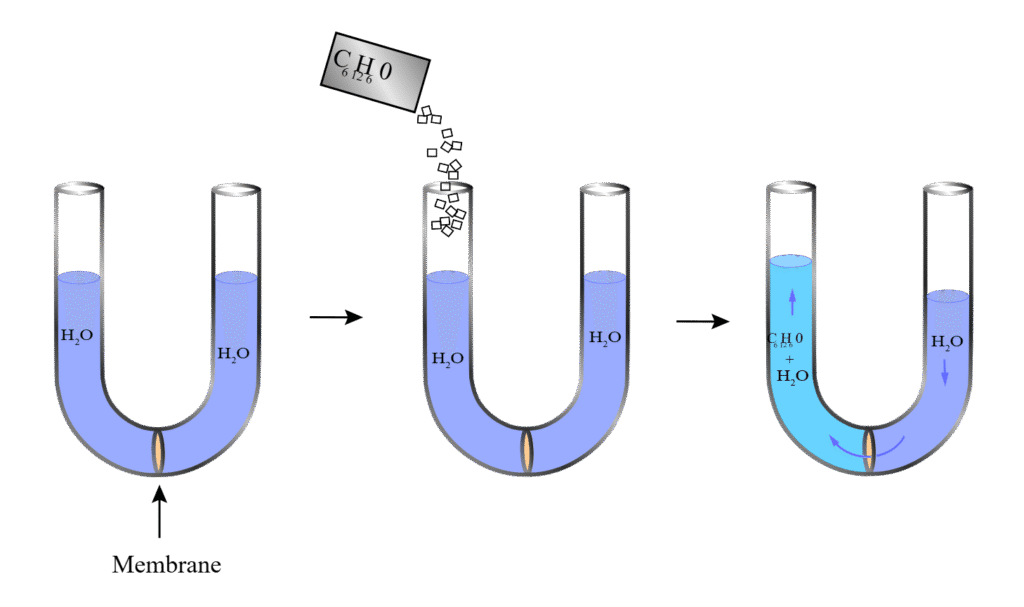
परासरण के प्रकार:
- परासरण (Osmosis): कम सांद्रता से अधिक सांद्रता की ओर विलायक का प्रवाह
- विपरीत परासरण (Reverse Osmosis): दाब लगाकर अधिक सांद्रता से कम सांद्रता की ओर विलायक का प्रवाह
जैविक महत्व:
- पौधों में जल का परिवहन
- कोशिकाओं में जल संतुलन
- किडनी का कार्य
- रक्त दाब का नियंत्रण
संख्यात्मक उदाहरण:
27°C पर 0.1M ग्लूकोज विलयन का परासरण दाब ज्ञात करें।
हल:
π = CRT = 0.1 × 0.0821 × 300 = 2.463 atm
सामान्य गलती चेतावनी: तापमान को केल्विन में बदलना न भूलें। 27°C = 300 K
वैंट हॉफ कारक (Van’t Hoff Factor)
परिभाषा (Definition)
वैंट हॉफ कारक (i) बताता है कि विलेय का एक अणु विलयन में कितने कणों में विभाजित होता है।
सूत्र: i = वास्तविक कणों की संख्या / विलयन में मिलाए गए अणुओं की संख्या
विभिन्न यौगिकों के लिए i मान
1. अवियोजी यौगिक (Non-electrolytes)
- ग्लूकोज, यूरिया, सुक्रोज: i = 1
- ये यौगिक आयनों में विभाजित नहीं होते
2. वियोजी यौगिक (Electrolytes)
- NaCl: Na⁺ + Cl⁻ → i = 2
- CaCl₂: Ca²⁺ + 2Cl⁻ → i = 3
- Al₂(SO₄)₃: 2Al³⁺ + 3SO₄²⁻ → i = 5
3. कमजोर वियोजन (Weak Dissociation)
वास्तविक i मान सैद्धांतिक मान से कम होता है क्योंकि:
- पूर्ण वियोजन नहीं होता
- आयन युग्मन (Ion pairing) होता है
संशोधित सूत्र (Modified Equations)
संयोजी गुणधर्मों के लिए संशोधित सूत्र:
- वाष्प दाब अवनमन: ΔP = i × XB × P°
- क्वथनांक वृद्धि: ΔTb = i × Kb × m
- हिमांक अवनमन: ΔTf = i × Kf × m
- परासरण दाब: π = i × CRT
संख्यात्मक उदाहरण:
0.1 molal NaCl विलयन का हिमांक ज्ञात करें (i = 1.8)
हल:
ΔTf = i × Kf × m = 1.8 × 1.86 × 0.1 = 0.3348 K
नया हिमांक = 0 – 0.3348 = -0.3348°C
आणविक द्रव्यमान का निर्धारण (Determination of Molecular Mass)
संयोजी गुणधर्मों का उपयोग करके अज्ञात यौगिकों का आणविक द्रव्यमान ज्ञात किया जा सकता है।
विधि 1: क्वथनांक वृद्धि विधि
सूत्र: M = (Kb × w × 1000)/(ΔTb × W)
जहाँ:
- M = आणविक द्रव्यमान
- w = विलेय का द्रव्यमान (g)
- W = विलायक का द्रव्यमान (g)
- ΔTb = क्वथनांक वृद्धि (K)
विधि 2: हिमांक अवनमन विधि
सूत्र: M = (Kf × w × 1000)/(ΔTf × W)
विधि 3: परासरण दाब विधि
सूत्र: M = (wRT)/(πV)
फायदे:
- कम सांद्रता पर भी सटीक परिणाम
- प्रोटीन और पॉलिमर के लिए उपयुक्त
- कमरे के तापमान पर मापा जा सकता है

संख्यात्मक उदाहरण:
एक अज्ञात यौगिक के 2g को 100g पानी में घोलने पर हिमांक में 0.186 K की कमी होती है। यौगिक का आणविक द्रव्यमान ज्ञात करें।
हल:
M = (1.86 × 2 × 1000)/(0.186 × 100) = 200 g/mol
वियोजन की मात्रा (Degree of Dissociation)
परिभाषा
वियोजन की मात्रा (α) बताती है कि कुल अणुओं का कितना भाग आयनों में वियोजित हो गया है।
सूत्र: α = (i – 1)/(n – 1)
जहाँ:
- α = वियोजन की मात्रा
- i = वैंट हॉफ कारक
- n = एक अणु से बनने वाले आयनों की संख्या
उदाहरण: NaCl के लिए
यदि i = 1.8, तो
α = (1.8 – 1)/(2 – 1) = 0.8 या 80%
अर्थात् 80% NaCl अणु आयनों में वियोजित हो गए हैं।
असामान्य आणविक द्रव्यमान (Abnormal Molecular Mass)
संयोजन की स्थिति में (Association)
जब अणु आपस में जुड़ते हैं:
- देखा गया आणविक द्रव्यमान > वास्तविक आणविक द्रव्यमान
- i < 1
- उदाहरण: बेंजोइक अम्ल का बेंजीन में द्विलक बनाना
वियोजन की स्थिति में (Dissociation)
जब अणु आयनों में टूटते हैं:
- देखा गया आणविक द्रव्यमान < वास्तविक आणविक द्रव्यमान
- i > 1
- उदाहरण: NaCl का पानी में आयनीकरण
प्रक्रिया विश्लेषण: बेंजोइक अम्ल का द्विलकीकरण
- दो बेंजोइक अम्ल अणु पास आते हैं
- हाइड्रोजन बंधन बनते हैं
- (C₆H₅COOH)₂ द्विलक बनता है
- कणों की संख्या आधी हो जाती है
- संयोजी गुणधर्म आधे हो जाते हैं
व्यावहारिक अनुप्रयोग (Practical Applications)
1. चिकित्सा क्षेत्र में (Medical Applications)
- अंतःशिरा द्रव (IV Fluids): 0.9% NaCl विलयन (सामान्य नमकीन पानी) रक्त के समपरासरी होता है
- डायलिसिस: किडनी के मरीजों के लिए रक्त शुद्धीकरण
- आँखों की दवाएँ: आँसुओं के समपरासरी विलयन
2. खाद्य उद्योग में (Food Industry)
- संरक्षण: नमक और चीनी का उपयोग करके माइक्रोब्स से पानी निकालना
- जैम और अचार: उच्च सांद्रता के कारण लंबे समय तक सुरक्षित
- डिब्बाबंद खाना: परासरण दाब नियंत्रण
3. पर्यावरण विज्ञान में (Environmental Science)
- समुद्री जल का विलवणीकरण: विपरीत परासरण विधि
- अपशिष्ट जल उपचार: संयोजी गुणधर्मों का उपयोग
- मिट्टी की लवणता: पौधों पर प्रभाव
4. औद्योगिक अनुप्रयोग (Industrial Applications)
- रसायन उद्योग: विलायक निष्कर्षण
- पेट्रोलियम उद्योग: तेल शुद्धीकरण
- फार्मास्यूटिकल: दवा निर्माण में विलयन
वास्तविक जीवन में रसायन: क्या आप जानते हैं कि समुद्री मछलियाँ मीठे पानी में और मीठे पानी की मछलियाँ समुद्री पानी में क्यों नहीं जी सकतीं? यह परासरण दाब के कारण होता है!
सामान्य गलतियाँ और उनसे बचाव (Common Mistakes and Prevention)
1. इकाइयों की गलतियाँ
गलत: मोलरता में आयतन mL में लेना
सही: मोलरता के लिए हमेशा आयतन L में लें
2. तापमान की गलतियाँ
गलत: परासरण दाब की गणना में तापमान °C में लेना
सही: हमेशा तापमान को केल्विन (K) में बदलें
3. मोल प्रभाज की गलतियाँ
गलत: मोल प्रभाज में केवल विलेय के मोल लेना
सही: कुल मोल (विलायक + विलेय) का उपयोग करें
4. वैंट हॉफ कारक की गलतियाँ
गलत: सभी यौगिकों के लिए i = 1 मानना
सही: वियोजन के आधार पर i का मान निर्धारित करें
परीक्षा रणनीति (Exam Strategy)
महत्वपूर्ण सूत्र (Important Formulas)
याददाश्त के लिए युक्ति: “मरम पान” – मोलरता, राउल्ट, मोललता, पारासरण, वैंनट हॉफ
- मोलरता: M = n/V(L)
- मोललता: m = n/W(kg)
- राउल्ट का नियम: PA = XA × P°A
- परासरण दाब: π = iCRT
- संयोजी गुणधर्म: ΔT = i × K × m
प्रश्न पैटर्न विश्लेषण
1 अंक के प्रश्न (1 Mark Questions)
- परिभाषाएँ
- सूत्र
- इकाइयाँ
- उदाहरण
उदाहरण प्रश्न: मोललता की इकाई लिखें।
उत्तर: mol kg⁻¹
2 अंक के प्रश्न (2 Marks Questions)
- छोटी गणनाएँ
- तुलना
- कारण सहित उत्तर
उदाहरण प्रश्न: आदर्श विलयन की दो विशेषताएँ लिखें।
3 अंक के प्रश्न (3 Marks Questions)
- मध्यम कठिनाई की गणनाएँ
- व्याख्या सहित उत्तर
- आरेख
5 अंक के प्रश्न (5 Marks Questions)
- जटिल संख्यात्मक प्रश्न
- तुलनात्मक अध्ययन
- सिद्धांत की व्याख्या
अभ्यास प्रश्न (Practice Questions)
बहुविकल्पीय प्रश्न (Multiple Choice Questions)
प्रश्न 1: 0.1 M ग्लूकोज विलयन में ग्लूकोज का मोल प्रभाज है:
(a) 0.1
(b) 0.0018
(c) 0.18
(d) 1.8
हल:
विलायक (पानी) के मोल = 1000/18 = 55.56 mol
विलेय (ग्लूकोज) के मोल = 0.1 mol (1L में)
मोल प्रभाज = 0.1/(55.56 + 0.1) = 0.0018
उत्तर: (b)
प्रश्न 2: निम्न में से कौन सा संयोजी गुणधर्म नहीं है?
(a) परासरण दाब
(b) पृष्ठ तनाव
(c) हिमांक अवनमन
(d) क्वथनांक वृद्धि
उत्तर: (b) पृष्ठ तनाव विलेय की प्रकृति पर निर्भर करता है, संख्या पर नहीं।
प्रश्न 3: CaCl₂ का वैंट हॉफ कारक है:
(a) 1
(b) 2
(c) 3
(d) 4
हल: CaCl₂ → Ca²⁺ + 2Cl⁻ (कुल 3 आयन)
उत्तर: (c)
संख्यात्मक प्रश्न (Numerical Problems)
प्रश्न 4: 500 mL पानी में 30g यूरिया (NH₂CONH₂) घोलने पर बने विलयन की मोललता ज्ञात करें।
हल:
यूरिया का आणविक द्रव्यमान = 14×2 + 1×4 + 12 + 16 = 60 g/mol
यूरिया के मोल = 30/60 = 0.5 mol
पानी का द्रव्यमान = 0.5 kg
मोललता = 0.5/0.5 = 1 m
प्रश्न 5: 27°C पर 5% (w/v) ग्लूकोज विलयन का परासरण दाब ज्ञात करें।
हल:
5% (w/v) का अर्थ: 100 mL में 5g ग्लूकोज
1000 mL में ग्लूकोज = 50g
ग्लूकोज के मोल = 50/180 = 0.278 mol
मोलरता = 0.278 M
तापमान = 27 + 273 = 300 K
π = CRT = 0.278 × 0.0821 × 300 = 6.84 atm
केस स्टडी प्रश्न (Case Study Questions)
प्रश्न 6: एक रसायनज्ञ को पता चला कि समुद्री पानी में नमक की सांद्रता लगभग 3.5% है। इस आधार पर निम्न प्रश्नों के उत्तर दें:
(a) यदि समुद्री पानी का घनत्व 1.025 g/mL है तो NaCl की मोलरता ज्ञात करें।
(b) इस विलयन का हिमांक क्यों 0°C से कम होगा?
(c) मछलियों के कोशिकाओं में परासरण दाब कैसे संतुलित होता है?
हल:
(a) 1000 mL समुद्री पानी का द्रव्यमान = 1025g
NaCl का द्रव्यमान = 1025 × 0.035 = 35.875g
NaCl के मोल = 35.875/58.5 = 0.613 mol
मोलरता = 0.613 M
(b) NaCl आयनों में वियोजित होकर हिमांक अवनमन दिखाता है
(c) मछलियों की कोशिकाओं में भी लवण की सांद्रता समुद्री पानी के बराबर होती है
आधुनिक अनुसंधान (Current Research)
1. नैनो-विलयन (Nano-solutions)
नैनो पार्टिकल्स के विलयन नई दवाओं और उपचारों में क्रांति ला रहे हैं।
2. आयनिक द्रव (Ionic Liquids)
पारंपरिक विलायकों का पर्यावरण-अनुकूल विकल्प।
3. स्मार्ट विलयन (Smart Solutions)
तापमान या pH के साथ गुणधर्म बदलने वाले विलयन।
निष्कर्ष (Conclusion)
विलयन रसायन विज्ञान का एक महत्वपूर्ण अध्याय है जो न केवल आपकी बोर्ड परीक्षा के लिए बल्कि दैनिक जीवन की समझ के लिए भी अत्यंत उपयोगी है। इस अध्याय की मुख्य बातें:
मुख्य सीख (Key Takeaways)
- विलयन सर्वत्र हैं: हमारे आसपास की हर चीज़ किसी न किसी रूप में विलयन है
- सांद्रता महत्वपूर्ण है: विलयन के गुणधर्म सांद्रता पर निर्भर करते हैं
- संयोजी गुणधर्म व्यावहारिक हैं: ये केवल सिद्धांत नहीं, बल्कि वास्तविक जीवन में उपयोगी हैं
- गणना की शुद्धता आवश्यक है: सूत्रों और इकाइयों पर विशेष ध्यान दें
परीक्षा की दृष्टि से महत्वपूर्ण बिंदु:
- सूत्र याद रखें: सभी महत्वपूर्ण सूत्रों का अभ्यास करें
- इकाइयों पर ध्यान दें: गलत इकाई के कारण अंक न खोएं
- चरणबद्ध हल लिखें: आंशिक अंक पाने के लिए
- आरेख बनाएं: जहाँ उपयुक्त हो, चित्र अवश्य बनाएं
आगे की तैयारी के लिए सुझाव:
- नियमित अभ्यास: रोजाना 2-3 संख्यात्मक प्रश्न हल करें
- अवधारणा मैपिंग: विभिन्न topics के बीच संबंध समझें
- प्रयोगशाला अनुभव: जहाँ संभव हो, व्यावहारिक कार्य करें
- समूह अध्ययन: साथियों के साथ चर्चा करें
याद रखें
याद रखें, रसायन विज्ञान केवल एक विषय नहीं है – यह हमारे चारों ओर की दुनिया को समझने का एक तरीका है। विलयन के सिद्धांत आपको न केवल परीक्षा में सफल बनाएंगे, बल्कि एक बेहतर वैज्ञानिक सोच भी विकसित करेंगे।
अंतिम सलाह: धैर्य रखें, नियमित अभ्यास करें, और संदेह होने पर तुरंत स्पष्टीकरण माँगें। आपकी मेहनत निश्चित रूप से रंग लाएगी!
“रसायन विज्ञान में सफलता का रहस्य समझना है, रटना नहीं।”
यह संपूर्ण अध्ययन गाइड आपकी CBSE कक्षा 12 की परीक्षा तैयारी के लिए तैयार किया गया है। नियमित अभ्यास और समझ के साथ आप इस अध्याय में निश्चित रूप से अच्छे अंक प्राप्त कर सकेंगे।
Recommended –


1 thought on “सीबीएसई कक्षा 12 रसायन विज्ञान: विलयन(Solutions) नोट्स | NCERT समाधान और महत्वपूर्ण प्रश्न”