क्या आपने कभी सोचा है कि लकड़ी जलने में कुछ मिनट क्यों लगते हैं, जबकि पटाखे एक सेकंड में फट जाते हैं? या फिर दूध को फ्रिज में रखने पर वह दिनों तक खराब क्यों नहीं होता, लेकिन कमरे के तापमान पर कुछ घंटों में ही खराब हो जाता है? इन सभी सवालों का जवाब रासायनिक गतिकी (Chemical Kinetics) में छुपा है।
रासायनिक गतिकी रसायन विज्ञान की वह शाखा है जो रासायनिक अभिक्रियाओं की गति का अध्ययन करती है। यह न केवल यह बताती है कि अभिक्रिया कितनी तेजी से होगी, बल्कि यह भी बताती है कि इस गति को कैसे नियंत्रित किया जा सकता है।
आधुनिक जीवन में Chemical Kinetics का महत्व अत्यधिक है। दवाइयों के निर्माण से लेकर खाद्य संरक्षण तक, प्रदूषण नियंत्रण से लेकर इंजन की दक्षता बढ़ाने तक – हर जगह रासायनिक गतिकी का सिद्धांत काम आता है। जब आप खाना पकाते हैं तो pressure cooker इसीलिए तेज पकाता है क्योंकि तापमान बढ़ने से अभिक्रिया की दर बढ़ जाती है।
सीखने के उद्देश्य (Learning Objectives)
इस अध्याय को पूरा करने के बाद आप निम्नलिखित में सक्षम होंगे:
- अभिक्रिया दर की अवधारणा को समझना और विभिन्न कारकों का प्रभाव जानना
- दर नियम और दर स्थिरांक के बीच अंतर करना और इनकी गणना करना
- अभिक्रिया की कोटि और आणविकता की पहचान करना
- आधा जीवन काल की गणना करना और इसका व्यावहारिक उपयोग समझना
- आर्हेनियस समीकरण का उपयोग करके सक्रियण ऊर्जा निकालना
- उत्प्रेरक की भूमिका समझना और औद्योगिक प्रक्रियाओं में इसका महत्व जानना
मुख्य भाग (Main Content)
1. रासायनिक अभिक्रिया की दर (Rate of Chemical Reactions)
रासायनिक अभिक्रिया की दर को समझने के लिए आइए एक सरल उदाहरण लेते हैं। मान लीजिए आप चीनी को पानी में घोल रहे हैं। यदि आप तेजी से हिलाएं तो चीनी जल्दी घुल जाएगी, धीरे हिलाने पर देर लगेगी। यही सिद्धांत रासायनिक अभिक्रियाओं पर भी लागू होता है।
परिभाषा: रासायनिक अभिक्रिया की दर एक निश्चित समय में अभिकारकों की सांद्रता में कमी या उत्पादों की सांद्रता में वृद्धि की दर है।
गणितीय रूप से:
- अभिकारक के लिए: दर = -d[A]/dt
- उत्पाद के लिए: दर = +d[B]/dt
यहाँ ऋणात्मक चिन्ह इसलिए लगाया जाता है क्योंकि अभिकारक की सांद्रता घट रही है।
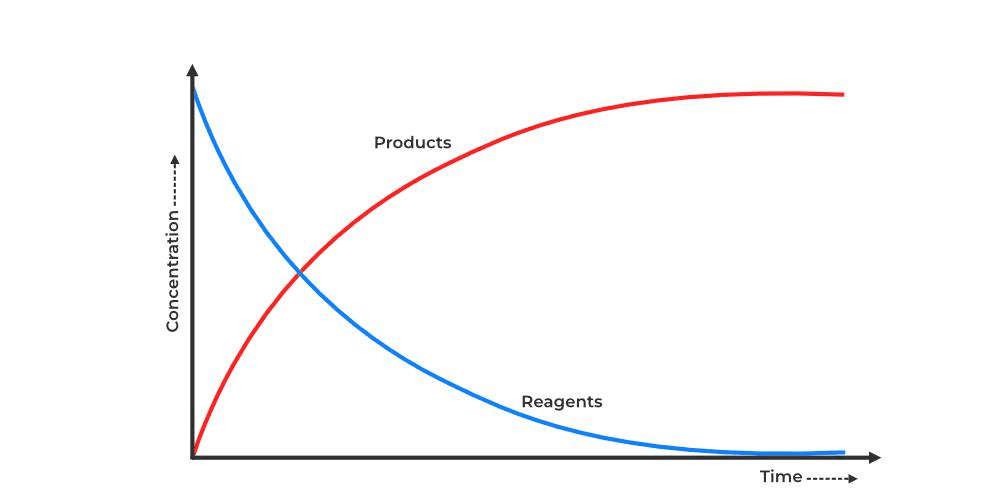
दर को प्रभावित करने वाले कारक:
- सांद्रता (Concentration): जैसे भीड़ भाड़ वाली जगह पर लोगों की टक्कर ज्यादा होती है, वैसे ही अधिक सांद्रता पर अणुओं की टक्कर ज्यादा होती है।
- तापमान (Temperature): गर्मी बढ़ने पर अणु तेजी से हिलते हैं, जैसे गर्म दिन में लोग तेज चलते हैं।
- उत्प्रेरक (Catalyst): यह एक सहायक की तरह काम करता है जो अभिक्रिया का रास्ता आसान बना देता है।
- सतह क्षेत्र (Surface Area): बारीक पाउडर तेजी से घुलता है क्योंकि इसका सतह क्षेत्र ज्यादा होता है।
Chemistry Check:
प्रश्न: यदि किसी अभिक्रिया में अभिकारक A की सांद्रता 10 मिनट में 0.5 M से 0.3 M हो जाती है, तो औसत दर क्या होगी?
उत्तर: औसत दर = -(0.3-0.5)/(10-0) = 0.02 M/min
2. दर नियम और दर स्थिरांक (Rate Laws and Rate Constants)
दर नियम एक गणितीय व्यंजक है जो अभिक्रिया की दर और अभिकारकों की सांद्रता के बीच संबंध स्थापित करता है। यह एक नुस्खे की तरह है जो बताता है कि कितनी मात्रा में कौन सा अभिकारक मिलाने पर अभिक्रिया कितनी तेज होगी।
सामान्य अभिक्रिया aA + bB → उत्पाद के लिए:
दर नियम: दर = k[A]^x[B]^y
यहाँ:
- k = दर स्थिरांक (Rate constant)
- x, y = अभिकारकों के सापेक्ष कोटि
- [A], [B] = अभिकारकों की सांद्रता
दर स्थिरांक (Rate Constant) की विशेषताएं:
- तापमान पर निर्भर: तापमान बढ़ने पर k का मान बढ़ता है
- सांद्रता पर निर्भर नहीं: k का मान अभिकारकों की सांद्रता से नहीं बदलता
- उत्प्रेरक से प्रभावित: उत्प्रेरक k का मान बढ़ा देता है
Real-World Chemistry:
एंजाइम हमारे शरीर में प्राकृतिक उत्प्रेरक का काम करते हैं। पेप्सिन एंजाइम प्रोटीन को तोड़ने की दर को लाखों गुना बढ़ा देता है, जिससे हमारा भोजन पच जाता है।
इकाइयां (Units):
शून्य कोटि की अभिक्रिया के लिए: k की इकाई = mol L⁻¹ s⁻¹
प्रथम कोटि की अभिक्रिया के लिए: k की इकाई = s⁻¹
द्वितीय कोटि की अभिक्रिया के लिए: k की इकाई = L mol⁻¹ s⁻¹
Common Error Alert:
छात्र अक्सर दर स्थिरांक k को दर के साथ confused करते हैं। याद रखें – k constant है (केवल तापमान पर निर्भर), जबकि दर सांद्रता के साथ बदलती रहती है।
3. अभिक्रिया की कोटि (Order of Reactions)
अभिक्रिया की कोटि को समझने के लिए इसे एक रेसिपी के रूप में सोचिए। जैसे चाय बनाने में चीनी की मात्रा दोगुनी करने से मिठास दोगुनी हो जाती है, कुछ अभिक्रियाओं में भी अभिकारक की सांद्रता दोगुनी करने पर दर दोगुनी हो जाती है।
कोटि के प्रकार:
1. शून्य कोटि अभिक्रिया (Zero Order Reaction):
दर = k[A]⁰ = k
यहाँ दर अभिकारक की सांद्रता पर निर्भर नहीं करती।
उदाहरण: एंजाइम कैटेलिसिस में जब सभी एंजाइम अणु व्यस्त हों
समाकलित दर नियम: [A] = [A]₀ – kt
2. प्रथम कोटि अभिक्रिया (First Order Reaction):
दर = k[A]¹ = k[A]
सांद्रता दोगुनी करने पर दर भी दोगुनी हो जाती है।
उदाहरण: रेडियोएक्टिव क्षय
समाकलित दर नियम: ln[A] = ln[A]₀ – kt
3. द्वितीय कोटि अभिक्रिया (Second Order Reaction):
दर = k[A]²
सांद्रता दोगुनी करने पर दर चार गुनी हो जाती है।
उदाहरण: 2NO₂ → N₂O₄
समाकलित दर नियम: 1/[A] = 1/[A]₀ + kt
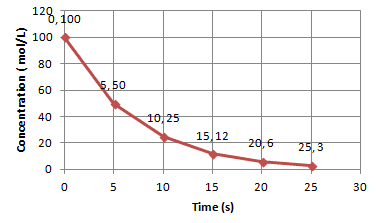
कोटि निर्धारण की विधियां:
- प्रारंभिक दर विधि (Initial Rate Method)
- समाकलित दर नियम विधि
- आधा जीवन काल विधि
Process Analysis – कोटि निर्धारण के चरण:
- विभिन्न प्रारंभिक सांद्रताओं पर प्रारंभिक दर मापें
- दर और सांद्रता के बीच संबंध स्थापित करें
- लघुगणक लेकर कोटि की गणना करें
- परिणाम की पुष्टि करें
4. आधा जीवन काल (Half-Life)
आधा जीवन काल वह समय है जिसमें अभिकारक की प्रारंभिक सांद्रता आधी हो जाती है। इसे t₁/₂ से प्रदर्शित करते हैं।
विभिन्न कोटि के लिए आधा जीवन काल:
शून्य कोटि:
t₁/₂ = [A]₀/2k
आधा जीवन काल प्रारंभिक सांद्रता पर निर्भर करता है।
प्रथम कोटि:
t₁/₂ = 0.693/k
आधा जीवन काल स्थिर रहता है, सांद्रता पर निर्भर नहीं करता।
द्वितीय कोटि:
t₁/₂ = 1/k[A]₀
आधा जीवन काल प्रारंभिक सांद्रता के व्युत्क्रमानुपाती होता है।
Historical Context:
मैडम क्यूरी ने रेडियम की खोज करते समय आधा जीवन काल की अवधारणा दी थी। उन्होंने पाया कि रेडियोएक्टिव पदार्थों का क्षय एक निश्चित पैटर्न में होता है।
व्यावहारिक उपयोग:
- कार्बन डेटिंग: C-14 का आधा जीवन काल 5730 साल है
- दवाओं का metabolism: शरीर में दवा कितनी देर तक रहेगी
- खाद्य संरक्षण: भोजन कितनी देर तक सुरक्षित रहेगा
Chemistry Check Box:
प्रश्न: यदि किसी प्रथम कोटि अभिक्रिया का दर स्थिरांक 0.0693 min⁻¹ है, तो आधा जीवन काल क्या होगा?
उत्तर: t₁/₂ = 0.693/k = 0.693/0.0693 = 10 मिनट
5. तापमान का प्रभाव (Effect of Temperature)
तापमान बढ़ने पर अभिक्रिया की दर क्यों बढ़ जाती है? इसे समझने के लिए आइए एक उदाहरण लेते हैं। ठंडे दिन में लोग धीरे-धीरे चलते हैं, लेकिन गर्म दिन में तेजी से। अणुओं के साथ भी यही होता है।
तापमान बढ़ने पर:
- अणुओं की गतिज ऊर्जा बढ़ती है
- टक्कर की आवृत्ति बढ़ती है
- प्रभावी टक्करों की संख्या बढ़ती है
तापमान गुणांक (Temperature Coefficient):
अधिकतर अभिक्रियाओं के लिए तापमान में 10°C की वृद्धि से दर लगभग दोगुनी हो जाती है।
तापमान गुणांक = k(T+10)/k(T) ≈ 2-3
Real-World Chemistry:
रेफ्रिजरेटर में भोजन इसीलिए देर तक रहता है क्योंकि कम तापमान पर बैक्टीरिया की वृद्धि की दर बहुत धीमी हो जाती है।
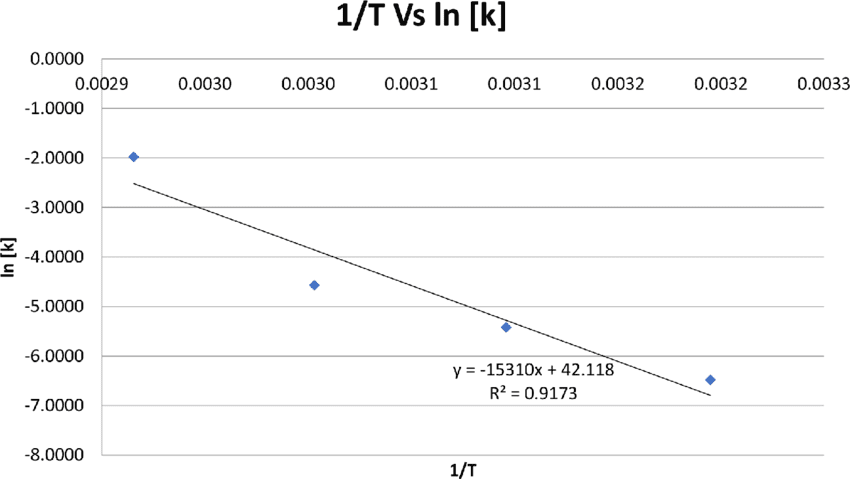
6. आर्हेनियस समीकरण (Arrhenius Equation)
स्वांते आर्हेनियस ने 1889 में एक महत्वपूर्ण समीकरण दिया जो तापमान और दर स्थिरांक के बीच संबंध स्थापित करता है।
आर्हेनियस समीकरण:
k = Ae^(-Ea/RT)
या लघुगणक रूप में:
ln k = ln A – Ea/RT
यहाँ:
- k = दर स्थिरांक
- A = आवृत्ति कारक (Frequency factor)
- Ea = सक्रियण ऊर्जा
- R = गैस नियतांक (8.314 J mol⁻¹ K⁻¹)
- T = परम तापमान (Kelvin में)
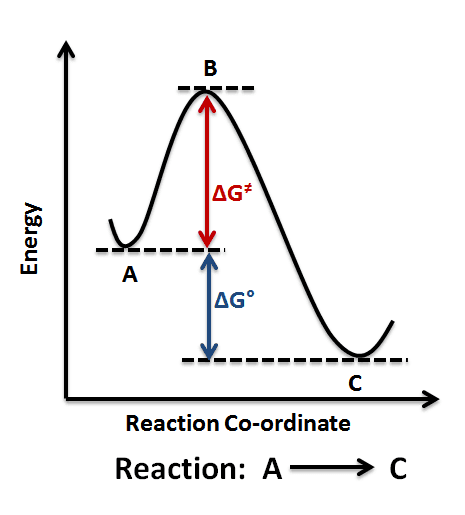
सक्रियण ऊर्जा (Activation Energy):
सक्रियण ऊर्जा वह न्यूनतम ऊर्जा है जो अभिकारक अणुओं में उत्पाद बनाने के लिए होनी चाहिए। इसे एक पहाड़ की तरह समझिए – जैसे पहाड़ पार करने के लिए एक निश्चित ऊंचाई तक चढ़ना पड़ता है।
सक्रियण ऊर्जा की गणना:
दो अलग तापमानों पर:
ln(k₂/k₁) = (Ea/R)(1/T₁ – 1/T₂)
Process Analysis – सक्रियण ऊर्जा निकालने के चरण:
- दो या अधिक तापमानों पर दर स्थिरांक मापें
- ln k vs 1/T का ग्राफ बनाएं
- ढाल से सक्रियण ऊर्जा निकालें: ढाल = -Ea/R
- आवृत्ति कारक A निकालें
7. उत्प्रेरक (Catalysts)
उत्प्रेरक वह पदार्थ है जो अभिक्रिया की दर को बढ़ा देता है लेकिन स्वयं अपरिवर्तित रह जाता है। यह एक कुशल गाइड की तरह है जो आपको मंजिल तक पहुंचने का आसान रास्ता दिखाता है।
उत्प्रेरक की विशेषताएं:
- अपरिवर्तित रहता है: अभिक्रिया के अंत में वापस मिल जाता है
- सक्रियण ऊर्जा कम करता है: आसान रास्ता प्रदान करता है
- समतुलन स्थिति नहीं बदलता: केवल गति बढ़ाता है
- अल्प मात्रा में प्रभावी: बहुत कम मात्रा में काम करता है
उत्प्रेरक के प्रकार:
1. समांगी उत्प्रेरक (Homogeneous Catalyst):
उत्प्रेरक और अभिकारक एक ही अवस्था में होते हैं।
उदाहरण: SO₂ + ½O₂ → SO₃ (NO के साथ)
2. विषमांगी उत्प्रेरक (Heterogeneous Catalyst):
उत्प्रेरक और अभिकारक अलग अवस्था में होते हैं।
उदाहरण: हैबर प्रक्रिया में Fe उत्प्रेरक
3. एंजाइम उत्प्रेरण (Enzyme Catalysis):
जैविक उत्प्रेरक जो बहुत ही विशिष्ट होते हैं।
उदाहरण: इन्वर्टेज एंजाइम sucrose को glucose और fructose में तोड़ता है
औद्योगिक महत्व:
- हैबर प्रक्रिया: अमोनिया बनाने में Fe उत्प्रेरक
- संपर्क प्रक्रिया: सल्फ्यूरिक एसिड बनाने में V₂O₅ उत्प्रेरक
- पेट्रोलियम रिफाइनिंग: क्रैकिंग में zeolite उत्प्रेरक
- वाहन में: CO को CO₂ में बदलने के लिए catalytic converter
Current Research:
आजकल वैज्ञानिक नैनो-उत्प्रेरक बना रहे हैं जो और भी अधिक प्रभावी हैं। ये इतने छोटे होते हैं कि एक चम्मच में अरबों कण होते हैं!
8. टक्कर सिद्धांत (Collision Theory)
टक्कर सिद्धांत अभिक्रिया की दर को समझाने का एक मौलिक सिद्धांत है। इसके अनुसार अभिक्रिया तभी होती है जब अणु आपस में टकराते हैं।
टक्कर सिद्धांत की मुख्य बातें:
- अणुओं में टक्कर होनी चाहिए
- टक्कर में पर्याप्त ऊर्जा होनी चाहिए (सक्रियण ऊर्जा से अधिक)
- टक्कर सही दिशा में होनी चाहिए (उचित अभिविन्यास)
प्रभावी टक्कर:
सभी टक्करें अभिक्रिया नहीं कराती। केवल वे टक्करें जिनमें:
- पर्याप्त ऊर्जा हो
- सही अभिविन्यास हो
उदाहरण के लिए, H₂ + I₂ → 2HI अभिक्रिया में H₂ अणु को I₂ के बीच में टकराना चाहिए, किनारे पर नहीं।
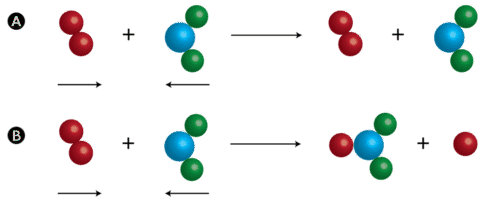
टक्कर की आवृत्ति:
प्रति सेकंड होने वाली टक्करों की संख्या को टक्कर आवृत्ति कहते हैं। यह निर्भर करती है:
- अणुओं की संख्या (सांद्रता पर)
- अणुओं की गति (तापमान पर)
- अणुओं का आकार
Mnemonic याददाश्त की तरकीब:
TES – T (टक्कर), E (ऊर्जा), S (सही दिशा) – तीनों चाहिए अभिक्रिया के लिए!
9. अभिक्रिया तंत्र (Reaction Mechanism)
अधिकतर अभिक्रियाएं एक ही चरण में नहीं होतीं, बल्कि कई छोटे चरणों में होती हैं। इन चरणों के क्रम को अभिक्रिया तंत्र कहते हैं।
मुख्य अवधारणाएं:
1. प्राथमिक चरण (Elementary Steps):
वे चरण जो एक ही बार में होते हैं।
2. मध्यवर्ती (Intermediate):
वे पदार्थ जो बनते और टूटते रहते हैं।
3. दर निर्धारक चरण (Rate Determining Step):
सबसे धीमा चरण जो पूरी अभिक्रिया की दर तय करता है।
Process Analysis – तंत्र प्रस्तावित करने के चरण:
- समग्र अभिक्रिया लिखें
- संभावित चरण सुझाएं
- मध्यवर्तियों की पहचान करें
- दर नियम से मिलान करें
उदाहरण: 2NO + O₂ → 2NO₂
चरण 1: NO + NO → N₂O₂ (तेज़)
चरण 2: N₂O₂ + O₂ → 2NO₂ (धीमा)
यहाँ चरण 2 दर निर्धारक है।
10. फोटो-रसायन और साम्यावस्था गतिकी (Photochemistry and Equilibrium Kinetics)
फोटो-रसायन:
प्रकाश की उपस्थिति में होने वाली अभिक्रियाएं। उदाहरण:
- फोटोसिंथेसिस में CO₂ + H₂O → ग्लूकोज
- ओजोन परत का विघटन
- फोटोग्राफी में AgBr का अपघटन
साम्यावस्था गतिकी:
उत्क्रमणीय अभिक्रियाओं में:
A + B ⇌ C + D
साम्यावस्था पर: आगे की दर = पीछे की दर
k₁[A][B] = k₋₁[C][D]
साम्य स्थिरांक K = k₁/k₋₁
प्रैक्टिस प्रश्न (Practice Problems)
वस्तुनिष्ठ प्रश्न (MCQs):
प्रश्न 1: शून्य कोटि अभिक्रिया के लिए दर स्थिरांक की इकाई क्या होगी?
(a) s⁻¹ (b) mol L⁻¹ s⁻¹ (c) L mol⁻¹ s⁻¹ (d) mol² L⁻² s⁻¹
उत्तर: (b) mol L⁻¹ s⁻¹
व्याख्या: शून्य कोटि में दर = k, इसलिए k की इकाई दर के समान होगी।
प्रश्न 2: प्रथम कोटि अभिक्रिया का आधा जीवन काल:
(a) प्रारंभिक सांद्रता पर निर्भर करता है
(b) समय के साथ बदलता है
(c) स्थिर रहता है
(d) तापमान पर निर्भर नहीं करता
उत्तर: (c) स्थिर रहता है
व्याख्या: प्रथम कोटि में t₁/₂ = 0.693/k, जो सांद्रता पर निर्भर नहीं करता।
प्रश्न 3: आर्हेनियस समीकरण में A क्या दर्शाता है?
(a) सक्रियण ऊर्जा (b) आवृत्ति कारक (c) दर स्थिरांक (d) गैस नियतांक
उत्तर: (b) आवृत्ति कारक
प्रश्न 4: उत्प्रेरक का मुख्य कार्य क्या है?
(a) साम्यावस्था बदलना (b) अभिकारक की मात्रा बढ़ाना
(c) सक्रियण ऊर्जा कम करना (d) तापमान बढ़ाना
उत्तर: (c) सक्रियण ऊर्जा कम करना
प्रश्न 5: टक्कर सिद्धांत के अनुसार अभिक्रिया होने के लिए क्या आवश्यक है?
(a) केवल टक्कर (b) केवल ऊर्जा
(c) टक्कर + पर्याप्त ऊर्जा + सही अभिविन्यास (d) केवल सही अभिविन्यास
उत्तर: (c) टक्कर + पर्याप्त ऊर्जा + सही अभिविन्यास
गणितीय प्रश्न (Numerical Problems):
प्रश्न 6: किसी प्रथम कोटि अभिक्रिया में प्रारंभिक सांद्रता 0.8 M है। यदि दर स्थिरांक 0.693 min⁻¹ है, तो 2 मिनट बाद सांद्रता क्या होगी?
हल:
प्रथम कोटि के लिए: ln[A] = ln[A]₀ – kt
ln[A] = ln(0.8) – 0.693 × 2
ln[A] = -0.223 – 1.386 = -1.609
[A] = e⁻¹·⁶⁰⁹ = 0.2 M
प्रश्न 7: यदि तापमान 300K से 310K करने पर दर स्थिरांक 2.0 × 10⁻³ से 4.0 × 10⁻³ हो जाता है, तो सक्रियण ऊर्जा निकालें।
हल:
ln(k₂/k₁) = (Ea/R)(1/T₁ – 1/T₂)
ln(4.0 × 10⁻³/2.0 × 10⁻³) = (Ea/8.314)(1/300 – 1/310)
ln(2) = (Ea/8.314)(1.077 × 10⁻⁴)
0.693 = Ea × 1.296 × 10⁻⁵
Ea = 53.5 kJ/mol
प्रश्न 8: द्वितीय कोटि अभिक्रिया में प्रारंभिक सांद्रता 0.1 M है और दर स्थिरांक 0.05 L mol⁻¹ min⁻¹ है। आधा जीवन काल निकालें।
हल:
द्वितीय कोटि के लिए: t₁/₂ = 1/k[A]₀
t₁/₂ = 1/(0.05 × 0.1) = 1/0.005 = 200 मिनट
केस स्टडी प्रश्न:
प्रश्न 9: एक औषधि कंपनी ने पाया कि उनकी दवा का अपघटन प्रथम कोटि अनुसार होता है। 25°C पर इसका आधा जीवन काल 2 साल है। यदि दवा को 35°C पर संग्रहीत किया जाए और सक्रियण ऊर्जा 50 kJ/mol है, तो नए तापमान पर आधा जीवन काल क्या होगा?
हल:
चरण 1: 25°C पर k₁ निकालें
t₁/₂ = 0.693/k₁
k₁ = 0.693/2 = 0.3465 year⁻¹
चरण 2: आर्हेनियस समीकरण से k₂ निकालें
ln(k₂/k₁) = (50000/8.314)(1/298 – 1/308)
ln(k₂/0.3465) = 6016 × 1.089 × 10⁻⁴
k₂ = 0.3465 × e⁰·⁶⁵⁵ = 0.667 year⁻¹
चरण 3: नया आधा जीवन काल
t₁/₂ = 0.693/0.667 = 1.04 साल
तर्कसंगत प्रश्न:
प्रश्न 10: क्यों एंजाइम उत्प्रेरित अभिक्रियाएं बहुत तेज होती हैं लेकिन बहुत विशिष्ट भी होती हैं?
उत्तर: एंजाइम में एक विशेष क्षेत्र होता है जिसे सक्रिय स्थल (active site) कहते हैं। यह केवल एक विशेष substrate के साथ fit करता है, जैसे चाबी और ताला। इसी कारण:
- तेज़ी: सक्रियण ऊर्जा बहुत कम हो जाती है
- विशिष्टता: केवल एक प्रकार का substrate fit हो सकता है
सामान्य गलतियां और बचाव (Common Errors and Prevention)
गलती 1: कोटि और आणविकता को मिलाना
गलत धारणा: कोटि हमेशा रासायनिक समीकरण के गुणांकों के बराबर होती है।
सही बात: कोटि प्रयोगात्मक रूप से ज्ञात की जाती है, यह गुणांकों से भिन्न हो सकती है।
बचाव: हमेशा प्रयोगात्मक डेटा से कोटि निकालें।
गलती 2: दर और दर स्थिरांक को मिलाना
गलत धारणा: k और दर दोनों समान हैं।
सही बात: k स्थिर है (केवल तापमान पर निर्भर), दर सांद्रता के साथ बदलती है।
बचाव: k = स्थिरांक, दर = चर (variable)
गलती 3: इकाइयों की गलतियां
गलत: सभी कोटि की अभिक्रियाओं में k की इकाई समान लेना।
सही: हर कोटि के लिए k की इकाई अलग होती है।
बचाव: कोटि के अनुसार इकाई का फॉर्मूला याद रखें।
गलती 4: आधा जीवन काल की गलत गणना
गलत: सभी अभिक्रियाओं के लिए एक ही फॉर्मूला का प्रयोग।
सही: हर कोटि के लिए अलग फॉर्मूला है।
बचाव: पहले कोटि पहचानें, फिर उससे संबंधित फॉर्मूला लगाएं।
परीक्षा रणनीति (Exam Strategy)
समय प्रबंधन:
- 2 अंक के प्रश्न (5 मिनट): परिभाषा या छोटी गणना
- 3 अंक के प्रश्न (7-8 मिनट): तुलना या मध्यम गणना
- 5 अंक के प्रश्न (12-15 मिनट): विस्तृत गणना या व्याख्या
महत्वपूर्ण टॉपिक्स (उच्च प्राथमिकता):
- दर नियम और कोटि निर्धारण (हर साल आता है)
- आधा जीवन काल की गणना (गणितीय प्रश्न)
- आर्हेनियस समीकरण (ग्राफ के साथ)
- उत्प्रेरक के प्रकार और उदाहरण (2-3 अंक)
उत्तर लेखन तकनीक:
5 अंक के प्रश्न के लिए:
- परिभाषा (1 अंक)
- सूत्र (1 अंक)
- गणना के चरण (2 अंक)
- अंतिम उत्तर और इकाई (1 अंक)
3 अंक के प्रश्न के लिए:
- मुख्य बिंदु (1.5 अंक)
- उदाहरण या गणना (1 अंक)
- निष्कर्ष (0.5 अंक)
याददाश्त की तरकीबें:
- RICE Table: Reaction, Initial, Change, Equilibrium
- TEA Time: T(तापमान), E(एंजाइम), A(एसिड-बेस) सभी दर बढ़ाते हैं
- फॉर्मूला ट्रिक: “Zero Molar, First Second, Second Inverse” (इकाइयों के लिए)
वास्तविक जीवन में उपयोग (Real-Life Applications)
चिकित्सा क्षेत्र में:
- दवाओं का Pharmacokinetics: शरीर में दवा कितनी देर तक रहेगी
- एंजाइम थेरेपी: बीमारियों का इलाज एंजाइम से
- रेडियोथेरेपी: कैंसर के इलाज में रेडियोएक्टिव आइसोटोप
खाद्य उद्योग में:
- खाद्य संरक्षण: Preservatives कैसे काम करते हैं
- खाना पकाना: तापमान और समय का संबंध
- किण्वन प्रक्रिया: दही, शराब, ब्रेड बनाने में
पर्यावरण विज्ञान में:
- प्रदूषण नियंत्रण: Catalytic converters में
- ओजोन क्षय: CFC का प्रभाव
- जैविक अपघटन: कूड़े-करकट का प्राकृतिक नष्ट होना
औद्योगिक प्रक्रियाएं:
- हैबर प्रक्रिया: खाद बनाने के लिए NH₃
- संपर्क प्रक्रिया: H₂SO₄ बनाने में
- पेट्रोलियम रिफाइनिंग: गैसोलीन की गुणवत्ता बढ़ाने में
निष्कर्ष (Conclusion)
रासायनिक गतिकी (Chemical Kinetics) केवल एक theoretical subject नहीं है, बल्कि यह हमारे दैनिक जीवन के हर पहलू से जुड़ा है। खाना पकाने से लेकर दवाइयों के काम करने तक, हर जगह इसके सिद्धांत काम आते हैं।
मुख्य सीख:
- अभिक्रिया की दर को प्रभावित करने वाले कारकों को समझना जरूरी है
- कोटि निर्धारण हमेशा प्रयोगात्मक डेटा से करें
- आर्हेनियस समीकरण temperature और rate constant के बीच पुल का काम करता है
- उत्प्रेरक प्रकृति और उद्योग दोनों में महत्वपूर्ण भूमिका निभाते हैं
- टक्कर सिद्धांत अभिक्रिया की गति को समझने का सबसे सरल तरीका है
भविष्य की राह:
Chemical Kinetics की समझ आपको higher studies में बहुत काम आएगी:
- इंजीनियरिंग में: Reaction engineering, process design
- मेडिसिन में: Drug development, pharmacology
- रिसर्च में: Catalyst development, green chemistry
- उद्योग में: Process optimization, quality control
अंतिम प्रेरणा:
याद रखिए, हर महान वैज्ञानिक एक समय में student था। मैडम क्यूरी, आर्हेनियस, और अन्य सभी ने भी कभी इन्हीं concepts को सीखा था। आपकी मेहनत और समझ आपको न केवल अच्छे अंक दिलाएगी, बल्कि science की इस खूबसूरत दुनिया का हिस्सा भी बनाएगी।
“Chemical Kinetics सिखाती है कि जीवन में भी सही conditions, proper catalyst (मेहनत), और adequate activation energy (motivation) से कोई भी reaction (सपना) possible है!”
अभी से ही अपनी तैयारी शुरू करें, नियमित अभ्यास करें, और confidence के साथ exam में जाएं। आपकी सफलता निश्चित है! यह guide आपके Chemistry की journey में एक मील का पत्थर बने – यही हमारी कामना है।
Recommended –

