रंगों की अद्भुत दुनिया (The Fascinating World of Colors)
क्या आपने कभी सोचा है कि आपके खून का लाल रंग कहाँ से आता है? या फिर पौधों का हरा रंग क्यों होता है? जब आप सुबह चाय बनाते हैं और उसमें दूध मिलाते हैं, तो रंग क्यों बदल जाता है? ये सभी घटनाएं एक खास प्रकार के रासायनिक यौगिकों से जुड़ी हैं जिन्हें हम समन्वय यौगिक (Coordination Compounds) कहते हैं।
आपके घर में फोटोग्राफी की पुरानी फिल्म हो या सोने-चांदी की इलेक्ट्रोप्लेटिंग, कैंसर के इलाज में प्रयुक्त दवाइयां हों या खेतों में उर्वरक – हर जगह समन्वय यौगिकों का जादू चलता है। यहां तक कि जब आप रात में LED की रंग-बिरंगी रोशनी देखते हैं, तब भी ये यौगिक काम कर रहे होते हैं।
आज हम इस रोचक विषय की गहराई में उतरेंगे और समझेंगे कि ये अनोखे यौगिक कैसे बनते हैं, कैसे काम करते हैं, और सबसे महत्वपूर्ण बात – CBSE परीक्षा में इनसे कैसे प्रश्न पूछे जाते हैं। यह अध्याय न केवल आपको अच्छे अंक दिलाएगा बल्कि रसायन विज्ञान की एक नई दुनिया के दरवाजे भी खोलेगा।
अध्ययन का उद्देश्य (Learning Objectives)
इस व्यापक गाइड को पूरा करने के बाद आप निम्नलिखित कार्य कुशलता से कर सकेंगे:
- मूलभूत अवधारणाओं में महारत: समन्वय यौगिकों की परिभाषा, संरचना, महत्वपूर्ण शब्दावली और वर्गीकरण को गहराई से समझना
- Werner सिद्धांत की पूर्ण समझ: Alfred Werner के क्रांतिकारी सिद्धांत के सभी पहलुओं और इसके आधुनिक अनुप्रयोगों में दक्षता प्राप्त करना
- IUPAC नामकरण में विशेषज्ञता: जटिल से जटिल समन्वय यौगिकों का सही नामकरण और संरचना से नाम तथा नाम से संरचना बनाने की क्षमता
- समावयवता की गहरी पहचान: सभी प्रकार की समावयवता को पहचानना, उदाहरण देना और त्रिविमीय संरचनाओं का विश्लेषण करना
- बंधन सिद्धांतों का व्यावहारिक प्रयोग: VBT, CFT और LFT को समझकर चुंबकीय गुण, रंग और स्थिरता की व्याख्या करना
- परीक्षा उत्कृष्टता: CBSE पैटर्न के अनुसार 1 से 5 अंक तक के सभी प्रकार के प्रश्नों में विशेषज्ञता हासिल करना
समन्वय यौगिकों की मूल अवधारणाएं (Fundamental Concepts of Coordination Compounds)
समन्वय यौगिक क्या हैं? (What are Coordination Compounds?)
समन्वय यौगिक वे जटिल यौगिक हैं जिनमें एक केंद्रीय धातु परमाणु या आयन के चारों ओर कुछ अणु या आयन एक निश्चित त्रिविमीय व्यवस्था में जुड़े होते हैं। इन्हें जटिल यौगिक (Complex Compounds) भी कहा जाता है।
सरल शब्दों में समझें तो यह बिल्कुल उसी तरह है जैसे एक राजा के चारों ओर उसके मंत्री खड़े होते हैं। यहां केंद्रीय धातु परमाणु राजा है और चारों ओर के अणु या आयन मंत्री की तरह हैं।
मुख्य घटक (Key Components):
- केंद्रीय परमाणु/आयन (Central Atom/Ion): आमतौर पर d-ब्लॉक या f-ब्लॉक की धातु का परमाणु या आयन
- लिगंड (Ligands): केंद्रीय परमाणु से coordinate bond बनाने वाले अणु या आयन
- समन्वय गोला (Coordination Sphere): केंद्रीय परमाणु और लिगंड्स का पूरा समूह, जो वर्गाकार कोष्ठक [] में लिखा जाता है
- काउंटर आयन (Counter Ions): समन्वय गोला के बाहर स्थित आयन जो विद्युत उदासीनता बनाए रखते हैं
Chemistry Check: K₄[Fe(CN)₆] में केंद्रीय परमाणु कौन सा है? लिगंड क्या है? काउंटर आयन कौन से हैं?
समन्वय संख्या और ऑक्सीकरण अवस्था (Coordination Number and Oxidation State)
समन्वय संख्या (Coordination Number):
केंद्रीय परमाणु के चारों ओर directly attached होने वाले लिगंड परमाणुओं की कुल संख्या को समन्वय संख्या कहते हैं। यह आमतौर पर 2, 4, 6, 8 आदि होती है।
ऑक्सीकरण अवस्था (Oxidation State):
समन्वय यौगिक में केंद्रीय धातु परमाणु की ऑक्सीकरण अवस्था की गणना इस प्रकार करते हैं:
केंद्रीय धातु की ऑक्सीकरण अवस्था = कॉम्प्लेक्स का आवेश – सभी लिगंड्स के आवेशों का योग
Real-World Chemistry: विटामिन B₁₂ में कोबाल्ट की समन्वय संख्या 6 है और यह हमारे DNA synthesis के लिए अत्यंत महत्वपूर्ण है।
Werner का सिद्धांत: समन्वय रसायन की आधारशिला (Werner’s Theory: Foundation of Coordination Chemistry)
Alfred Werner: एक वैज्ञानिक क्रांति (Alfred Werner: A Scientific Revolution)
1893 में स्विस रसायनज्ञ Alfred Werner ने coordination chemistry में एक क्रांति ला दी। उस समय जब वैज्ञानिक इन जटिल यौगिकों को समझने में असमर्थ थे, Werner ने एक ऐसा सिद्धांत दिया जिसने पूरी तस्वीर बदल दी। इस महान कार्य के लिए उन्हें 1913 में रसायन विज्ञान का नोबेल पुरस्कार मिला।
Historical Context: Werner inorganic chemistry में Nobel Prize जीतने वाले पहले व्यक्ति थे। उनका काम इतना महत्वपूर्ण था कि आज भी coordination chemistry की बुनियाद Werner के सिद्धांत पर टिकी है।
Werner सिद्धांत के मुख्य सिद्धांत (Main Principles of Werner’s Theory)
1. द्विक संयोजकता (Double Valency)
Werner के अनुसार धातु परमाणुओं में दो प्रकार की संयोजकता होती है:
- प्राथमिक संयोजकता (Primary Valency):
- यह आयनीकरण योग्य संयोजकता है
- यह धातु की ऑक्सीकरण अवस्था के बराबर होती है
- यह विपरीत आवेश वाले आयनों द्वारा संतुष्ट होती है
- द्वितीयक संयोजकता (Secondary Valency):
- यह समन्वय संख्या के बराबर होती है
- यह हमेशा संतुष्ट रहती है
- इसकी एक निश्चित दिशा होती है
2. त्रिविमीय व्यवस्था (Three-Dimensional Arrangement)
द्वितीयक संयोजकता की एक निश्चित दिशा होती है, जिससे विभिन्न ज्यामितीय आकार बनते हैं।
3. आयनीकरण व्यवहार (Ionization Behavior)
केवल primary valency को संतुष्ट करने वाले आयन ही solution में free ions देते हैं।
Process Analysis – Werner Theory Application:
- CoCl₃·6NH₃ का विश्लेषण करें
- Co³⁺ की primary valency = 3 (तीन Cl⁻ से संतुष्ट)
- Co³⁺ की secondary valency = 6 (छह NH₃ से संतुष्ट)
- सूत्र: [Co(NH₃)₆]Cl₃
- AgNO₃ से तीन Cl⁻ precipitate होंगे
Werner सिद्धांत का प्रायोगिक प्रमाण (Experimental Evidence for Werner’s Theory)
PROCESS: Electrical Conductivity Measurements – Werner ने विभिन्न cobalt chloride-ammonia complexes की विद्युत चालकता मापी और पाया कि CoCl₃·6NH₃ तीन आयनों का व्यवहार करता है, CoCl₃·5NH₃ दो आयनों का, और CoCl₃·4NH₃ एक आयन का
Werner के समय में उपलब्ध तकनीकों से उन्होंने prove किया:
- विभिन्न complexes की अलग-अलग conductivity
- Precipitation reactions का अलग behavior
- Isomerism की उपस्थिति
लिगंड्स: समन्वय यौगिकों के निर्माण खंड (Ligands: Building Blocks of Coordination Compounds)
लिगंड क्या होते हैं? (What are Ligands?)
लिगंड वे अणु या आयन होते हैं जिनमें कम से कम एक lone pair of electrons होता है और जो केंद्रीय धातु परमाणु को donate कर सकते हैं। इन्हें Lewis bases भी कहा जाता है।
सरल उदाहरण के लिए, NH₃ में nitrogen पर एक lone pair है जो धातु परमाणु को दे सकता है। इसीलिए NH₃ एक लिगंड है।
दंतकता के आधार पर वर्गीकरण (Classification Based on Denticity)
1. एकदंती लिगंड (Monodentate Ligands)
- केवल एक coordinate bond बनाते हैं
- एक donor atom होता है
- उदाहरण: NH₃, H₂O, Cl⁻, F⁻, CN⁻, CO
2. द्विदंती लिगंड (Bidentate Ligands)
- दो coordinate bonds बनाते हैं
- दो donor atoms होते हैं
- उदाहरण:
- Ethylenediamine (en): H₂N-CH₂-CH₂-NH₂
- Oxalate (ox²⁻): C₂O₄²⁻
3. बहुदंती लिगंड (Polydentate Ligands)
- तीन या अधिक coordinate bonds बनाते हैं
- उदाहरण:
- EDTA (ethylenediaminetetraacetic acid): छह donor atoms
- DIEN (diethylenetriamine): तीन donor atoms
Chemistry Check: Glycine (NH₂CH₂COOH) में कितने donor atoms हैं? क्या यह chelating ligand है?
आवेश के आधार पर वर्गीकरण (Classification Based on Charge)
1. धनावेशित लिगंड (Cationic Ligands)
- बहुत कम common हैं
- उदाहरण: NO⁺, NH₂CH₃⁺
2. उदासीन लिगंड (Neutral Ligands)
- सबसे common type
- उदाहरण: NH₃, H₂O, CO, NO, py (pyridine)
3. ऋणावेशित लिगंड (Anionic Ligands)
- अधिकतर halides और simple anions
- उदाहरण: Cl⁻, Br⁻, I⁻, OH⁻, CN⁻, SCN⁻
केलेट प्रभाव (Chelate Effect)
जब एक polydentate ligand केंद्रीय परमाणु के साथ ring structure बनाता है, तो इसे chelation कहते हैं। यह process thermodynamically अधिक स्थिर होती है।
Real-World Chemistry: EDTA का उपयोग heavy metal poisoning के इलाज में किया जाता है क्योंकि यह toxic metals के साथ stable chelate बनाता है।
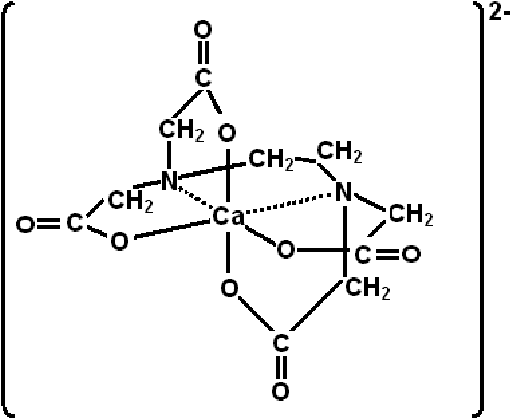
IUPAC नामकरण प्रणाली (IUPAC Nomenclature System)
नामकरण के मूल सिद्धांत (Basic Principles of Nomenclature)
IUPAC (International Union of Pure and Applied Chemistry) ने समन्वय यौगिकों के नामकरण के लिए specific rules बनाए हैं। ये rules worldwide accepted हैं और परीक्षा में भी इन्हीं का प्रयोग होता है।
Complex Cation का नामकरण (Naming Complex Cations)
नामकरण क्रम:
- पहले ligands का नाम (alphabetical order में)
- फिर central metal का नाम
- अंत में oxidation state (Roman numerals में कोष्ठक में)
उदाहरण: [Co(NH₃)₆]³⁺
- छह ammonia ligands = hexaammine
- Central metal = cobalt
- Oxidation state = (III)
- पूरा नाम: Hexaamminecobalt(III) ion
Complex Anion का नामकरण (Naming Complex Anions)
नामकरण क्रम:
- पहले ligands का नाम (alphabetical order में)
- Central metal का नाम + “ate” suffix
- Oxidation state (Roman numerals में कोष्ठक में)
उदाहरण: [Fe(CN)₆]⁴⁻
- छह cyanide ligands = hexacyano
- Central metal with -ate = ferrate
- Oxidation state = (II)
- पूरा नाम: Hexacyanoferrate(II) ion
मुख्य लिगंड्स के नाम (Names of Common Ligands)
उदासीन लिगंड्स:
- H₂O → aqua
- NH₃ → ammine (ध्यान दें: ammonia नहीं)
- CO → carbonyl
- NO → nitrosyl
- py (pyridine) → pyridine
ऋणावेशित लिगंड्स:
- Cl⁻ → chloro
- Br⁻ → bromo
- I⁻ → iodo
- OH⁻ → hydroxo
- CN⁻ → cyano
- SCN⁻ → isothiocyanato-S (जब S से attached हो)
- NCS⁻ → isothiocyanato-N (जब N से attached हो)
संख्या सूचक उपसर्ग (Numerical Prefixes):
- Simple ligands के लिए: mono-, di-, tri-, tetra-, penta-, hexa-
- Complex ligands के लिए: bis-, tris-, tetrakis-, pentakis-, hexakis-
Common Error Alert: अक्सर छात्र NH₃ को “ammonia” लिखते हैं जो गलत है। IUPAC नाम में यह “ammine” होता है।
पूर्ण यौगिक का नामकरण (Naming Complete Compounds)
नियम:
- Cation का नाम पहले, anion का बाद में
- यदि complex neutral है तो केवल complex का नाम
- Counter ions का नाम सामान्य rules के अनुसार
उदाहरण:
- K₄[Fe(CN)₆]: Potassium hexacyanoferrate(II)
- [Cr(NH₃)₆]Cl₃: Hexaamminechromium(III) chloride
- [Pt(NH₃)₂Cl₂]: Diamminedichloroplatinum(II)
Process Analysis – Systematic Nomenclature:
- Complex identify करें (cation, anion, या neutral)
- Central metal और उसकी oxidation state निकालें
- सभी ligands count करें
- Alphabetical order में arrange करें
- Appropriate prefixes add करें
- IUPAC rules apply करें
समावयवता: एक ही सूत्र, अलग गुण (Isomerism: Same Formula, Different Properties)
समावयवता coordination chemistry का एक fascinating aspect है। यह concept बताती है कि same molecular formula वाले compounds के अलग-अलग structures और properties हो सकते हैं।
संरचनात्मक समावयवता (Structural Isomerism)
1. आयनीकरण समावयवता (Ionization Isomerism)
यह तब होती है जब same ligand coordination sphere के अंदर और बाहर दोनों जगह हो सकता है।
उदाहरण:
- [Co(NH₃)₅Br]SO₄ (violet)
- [Co(NH₃)₅SO₄]Br (red)
पहचान का तरीका: AgNO₃ solution add करने पर:
- पहले compound में Br⁻ precipitate नहीं होगा
- दूसरे में Br⁻ precipitate होगा
2. जल-संयोजन समावयवता (Hydrate/Solvate Isomerism)
यह तब होती है जब water molecules coordination sphere के अंदर और बाहर अलग-अलग positions में हो सकते हैं।
Classic उदाहरण – Chromium Chloride Hydrates:
- [Cr(H₂O)₆]Cl₃ (violet) – सभी water molecules coordinated
- [Cr(H₂O)₅Cl]Cl₂·H₂O (green) – एक Cl⁻ coordinated, एक water बाहर
- [Cr(H₂O)₄Cl₂]Cl·2H₂O (dark green) – दो Cl⁻ coordinated, दो water बाहर
3. लिगंड समावयवता (Linkage Isomerism)
यह तब होती है जब एक ligand में multiple donor atoms हों और वह अलग-अलग atoms से coordinate कर सकता हो।
उदाहरण:
- [Co(NH₃)₅(NO₂)]Cl₂ – nitro complex (N से bonded)
- [Co(NH₃)₅(ONO)]Cl₂ – nitrito complex (O से bonded)
4. समन्वय समावयवता (Coordination Isomerism)
यह तब होती है जब दोनों cation और anion complex हों और ligands का exchange हो सकता हो।
उदाहरण:
- [Co(NH₃)₆][Cr(CN)₆]
- [Cr(NH₃)₆][Co(CN)₆]
त्रिविमीय समावयवता (Stereoisomerism)
1. ज्यामितीय समावयवता (Geometrical Isomerism)
Square Planar Complexes में:
- cis isomer: Similar ligands adjacent positions में
- trans isomer: Similar ligands opposite positions में
उदाहरण: [Pt(NH₃)₂Cl₂]
- cis-diamminedichloroplatinum(II)
- trans-diamminedichloroplatinum(II)
![cis and trans isomers of [Pt(NH₃)₂Cl₂] showing the square planar arrangement and different spatial orientations](https://solvefyai.com/wp-content/uploads/2025/10/image-18.png)
Octahedral Complexes में:
Ma₄b₂ type: [Co(NH₃)₄Cl₂]⁺
- cis isomer: दो Cl⁻ adjacent positions में (bond angle 90°)
- trans isomer: दो Cl⁻ opposite positions में (bond angle 180°)
Ma₃b₃ type: [Co(NH₃)₃Cl₃]
- fac (facial): तीन similar ligands एक face पर
- mer (meridional): तीन similar ligands एक meridian पर
2. प्रकाशीय समावयवता (Optical Isomerism)
यह chiral complexes में होती है। ये complexes polarized light की plane को rotate करते हैं।
शर्तें:
- Complex में symmetry plane नहीं होना चाहिए
- Mirror images superimposable नहीं होने चाहिए
उदाहरण: [Co(en)₃]³⁺
- यह complex highly symmetrical है लेकिन chiral है
- d-form और l-form (या Δ और Λ) exist करते हैं
Real-World Chemistry: Optical isomerism pharmaceuticals में बहुत important है क्योंकि अक्सर केवल एक enantiomer ही biologically active होता है।
Chemistry Check: [Cr(NH₃)₃Cl₃] में कितने geometrical isomers possible हैं? क्या optical isomerism भी संभव है?
बंधन सिद्धांत: समन्वय यौगिकों की संरचना को समझना (Bonding Theories: Understanding Structure of Coordination Compounds)
संयोजकता बंध सिद्धांत (Valence Bond Theory – VBT)
VBT के अनुसार coordination bonds का formation hybridized orbitals के overlap से होता है।
मुख्य सिद्धांत:
- Central metal atom के vacant orbitals ligands के filled orbitals के साथ overlap करते हैं
- Hybridization के type से geometry determine होती है
- Unpaired electrons की संख्या से magnetic properties का पता चलता है
Common Hybridization Patterns:
Coordination Number 4:
- sp³ hybridization: Tetrahedral geometry
- dsp² hybridization: Square planar geometry
Coordination Number 6:
- sp³d² hybridization: Octahedral geometry
- d²sp³ hybridization: Octahedral geometry (inner orbital complex)
PROCESS: VBT Analysis of [Ni(CN)₄]²⁻ – Ni²⁺ has d⁸ configuration, CN⁻ is strong field ligand causing electron pairing, dsp² hybridization occurs giving square planar geometry and diamagnetic behavior
उदाहरण विश्लेषण – [NiCl₄]²⁻:
- Ni²⁺ configuration: [Ar] 3d⁸
- Cl⁻ weak field ligand है
- No electron pairing
- sp³ hybridization
- Tetrahedral geometry
- 2 unpaired electrons → Paramagnetic
क्रिस्टल क्षेत्र सिद्धांत (Crystal Field Theory – CFT)
CFT एक electrostatic model है जो बताता है कि ligands के electric field के कारण central metal ion के d-orbitals की degeneracy कैसे break होती है।
मूल अवधारणा:
Ligands को point charges या dipoles माना जाता है जो central metal ion के d-orbitals को अलग-अलग तरीके से प्रभावित करते हैं।
Octahedral Crystal Field Splitting:
Free metal ion में सभी d-orbitals same energy पर होते हैं। लेकिन octahedral ligand field में ये दो groups में split हो जाते हैं:
t₂g orbitals (lower energy):
- dxy, dxz, dyz
- ये orbitals ligands से दूर होते हैं
- Energy = -0.6Δ₀
eg orbitals (higher energy):
- dx²-y², dz²
- ये orbitals ligands के direction में होते हैं
- Energy = +0.4Δ₀
Crystal Field Splitting Energy (Δ₀): eg और t₂g orbitals के बीच energy difference
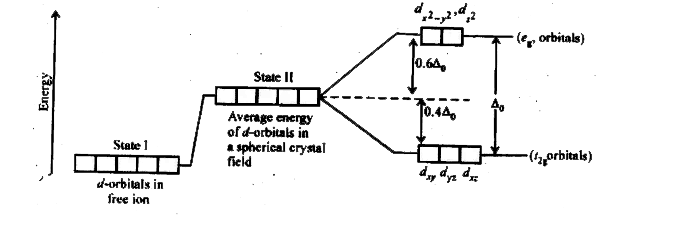
Tetrahedral Crystal Field Splitting:
Tetrahedral field में splitting pattern reverse होता है:
- e orbitals (lower energy): dz², dx²-y²
- t₂ orbitals (higher energy): dxy, dxz, dyz
- Δt = (4/9) × Δ₀
स्पेक्ट्रोकेमिकल श्रेणी (Spectrochemical Series)
Ligands को उनकी field strength के अनुसार arrange करने पर spectrochemical series मिलती है:
I⁻ < Br⁻ < SCN⁻ < Cl⁻ < S²⁻ < F⁻ < OH⁻ < C₂O₄²⁻ < H₂O < NCS⁻ < edta⁴⁻ < py < NH₃ < en < bipy < phen < NO₂⁻ < PPh₃ < CN⁻ < CO
← Weak field ligands Strong field ligands →
Strong Field vs Weak Field:
- Strong field ligands: Large Δ value, electron pairing होती है (low spin)
- Weak field ligands: Small Δ value, electrons unpaired रहते हैं (high spin)
Crystal Field Stabilization Energy (CFSE)
CFSE = (t₂g electrons × -0.4Δ₀) + (eg electrons × 0.6Δ₀) + Pairing Energy
उदाहरण: [Fe(H₂O)₆]²⁺ (high spin, d⁶)
- t₂g⁴ eg² configuration
- CFSE = (4 × -0.4Δ₀) + (2 × 0.6Δ₀) = -0.4Δ₀
Chemistry Check: [Fe(CN)₆]⁴⁻ में iron की electron configuration क्या होगी? यह high spin है या low spin?
Process Analysis – Color in Coordination Compounds:
- White light complex पर incident होती है
- d-d transitions के लिए specific wavelengths absorb होती हैं
- Absorbed wavelength के complementary color का observation होता है
- Transition की probability selection rules determine करती है
महत्वपूर्ण गुणधर्म (Important Properties)
चुंबकीय गुणधर्म (Magnetic Properties)
Diamagnetic Complexes:
- सभी electrons paired होते हैं
- Magnetic field से repel होते हैं
- Magnetic susceptibility negative
- उदाहरण: [Ni(CN)₄]²⁻, [Co(NH₃)₆]³⁺
Paramagnetic Complexes:
- Unpaired electrons मौजूद होते हैं
- Magnetic field की तरफ attract होते हैं
- Magnetic moment (μ) = √n(n+2) BM
- जहाँ n = unpaired electrons की संख्या
- उदाहरण: [NiCl₄]²⁻, [Fe(H₂O)₆]²⁺
Common Error Alert: Magnetic moment calculate करते समय केवल d-electrons count न करें। Unpaired electrons count करें।
रंग गुणधर्म (Color Properties)
d-d Transitions:
- Laporte forbidden transitions हैं (theoretically)
- Vibronic coupling के कारण weakly allowed हो जाते हैं
- Low intensity (ε < 100 L mol⁻¹ cm⁻¹)
- Visible region में absorption
Charge Transfer Transitions:
- MLCT (Metal to Ligand Charge Transfer)
- LMCT (Ligand to Metal Charge Transfer)
- High intensity (ε > 1000 L mol⁻¹ cm⁻¹)
- UV या visible region में
Color-Wavelength Relationship:
- Blue light absorb → Orange/Red color observe
- Red light absorb → Green/Blue color observe
- Green light absorb → Purple/Magenta color observe
Real-World Chemistry: Transition metal compounds के bright colors का use paints, dyes, और pigments में होता है।
व्यावहारिक अनुप्रयोग (Practical Applications)
औद्योगिक अनुप्रयोग (Industrial Applications)
1. Electroplating:
- [Ag(CN)₂]⁻ का use silver plating में
- [Au(CN)₂]⁻ का use gold plating में
- [Ni(NH₃)₆]²⁺ का use nickel plating में
PROCESS: Electroplating Process – Metal object को cathode बनाते हैं, coordination complex का solution electrolyte के रूप में use करते हैं, current pass करने पर metal ions reduce होकर object पर deposit हो जाते हैं
2. Photography (Traditional):
- [Ag(S₂O₃)₂]³⁻ fixing agent के रूप में
- Unused AgBr को dissolve करके remove करता है
- Film processing में essential step
3. Extraction Metallurgy:
Cyanide Process for Gold:
4Au + 8CN⁻ + O₂ + 2H₂O → 4[Au(CN)₂]⁻ + 4OH⁻
Mond Process for Nickel:
Ni + 4CO → [Ni(CO)₄] (volatile complex)
[Ni(CO)₄] → Ni + 4CO (at higher temperature)
जैविक महत्व (Biological Importance)
1. Hemoglobin:
- Fe²⁺-porphyrin complex
- Oxygen transport करता है
- CO poisoning में CO, O₂ को replace कर देता है (higher affinity)
2. Chlorophyll:
- Mg²⁺-porphyrin complex
- Photosynthesis का central component
- Light energy को chemical energy में convert करता है
3. Vitamin B₁₂ (Cyanocobalamin):
- Co³⁺ coordination complex
- DNA synthesis में important role
- Pernicious anemia के treatment में use होता है
4. Enzyme Functions:
- Carbonic anhydrase (Zn²⁺)
- Cytochrome oxidase (Cu²⁺, Fe³⁺)
- Carboxypeptidase (Zn²⁺)
Current Research: आजकल coordination compounds का use targeted cancer therapy, MRI contrast agents, catalysis, और solar energy conversion में extensive हो रहा है।
चिकित्सा विज्ञान में प्रयोग (Applications in Medicine)
1. Cancer Chemotherapy:
- Cisplatin: [Pt(NH₃)₂Cl₂] – cis isomer active, trans inactive
- Carboplatin: कम side effects
- Oxaliplatin: colorectal cancer के लिए
2. MRI Contrast Agents:
- Gadolinium complexes
- Better imaging के लिए use होते हैं
3. Antimicrobial Agents:
- Silver coordination compounds
- Wound dressing में antibacterial properties
विस्तृत अभ्यास प्रश्न (Comprehensive Practice Questions)
बहुविकल्पीय प्रश्न (Multiple Choice Questions)
प्रश्न 1: [Co(NH₃)₄Cl₂]Cl में cobalt का oxidation state है:
(a) +1 (b) +2 (c) +3 (d) +4
विस्तृत हल:
Complex ion का charge = +1 (क्योंकि एक Cl⁻ बाहर है)
माना Co का oxidation state = x
x + 4(0) + 2(-1) = +1
x – 2 = +1
x = +3
उत्तर: (c) +3
प्रश्न 2: Tetrahedral complex [NiCl₄]²⁻ में Ni का hybridization है:
(a) sp³ (b) dsp² (c) sp³d² (d) d²sp³
विस्तृत हल:
- Ni²⁺ का electronic configuration: [Ar] 3d⁸
- Cl⁻ weak field ligand है, कोई electron pairing नहीं
- Tetrahedral geometry के लिए sp³ hybridization
उत्तर: (a) sp³
प्रश्न 3: निम्न में से कौन सा bidentate ligand है?
(a) NH₃ (b) en (c) Cl⁻ (d) H₂O
विस्तृत हल:
- en (ethylenediamine) में दो NH₂ groups हैं
- दोनों में lone pairs हैं जो coordinate bonds बना सकते हैं
- इसलिए यह bidentate ligand है
उत्तर: (b) en
प्रश्न 4: [Fe(CN)₆]³⁻ में iron का magnetic moment लगभग है:
(a) 0 BM (b) 1.73 BM (c) 2.83 BM (d) 5.92 BM
विस्तृत हल:
- Fe³⁺ का configuration: [Ar] 3d⁵
- CN⁻ strong field ligand है
- Low spin complex: t₂g⁵ eg⁰
- 1 unpaired electron
- μ = √1(1+2) = √3 = 1.73 BM
उत्तर: (b) 1.73 BM
प्रश्न 5: [Pt(NH₃)₂Cl₂] के geometrical isomers की संख्या है:
(a) 0 (b) 1 (c) 2 (d) 3
विस्तृत हल:
- Square planar complex है
- Two types के ligands हैं (NH₃ और Cl⁻)
- cis और trans isomers possible हैं
उत्तर: (c) 2
संख्यात्मक प्रश्न (Numerical Problems)
प्रश्न 6: [Mn(H₂O)₆]²⁺ complex का magnetic moment calculate करें और बताएं कि यह high spin है या low spin।
विस्तृत हल:
- Mn²⁺ का electronic configuration: [Ar] 3d⁵
- H₂O weak field ligand है
- High spin configuration: t₂g³ eg²
- 5 unpaired electrons
- Magnetic moment = √n(n+2) = √5(5+2) = √35 = 5.92 BM
- निष्कर्ष: यह high spin complex है
प्रश्न 7: [Co(NH₃)₆]³⁺ complex का CFSE calculate करें।
विस्तृत हल:
- Co³⁺ का configuration: [Ar] 3d⁶
- NH₃ strong field ligand है → low spin
- Electron configuration: t₂g⁶ eg⁰
- CFSE = (6 × -0.4Δ₀) + (0 × 0.6Δ₀) = -2.4Δ₀
- उत्तर: CFSE = -2.4Δ₀
प्रश्न 8: K₃[Fe(CN)₆] में iron का oxidation state निकालें।
विस्तृत हल:
- Overall compound neutral है
- 3K⁺ का total charge = +3
- Complex ion का charge = -3
- माना Fe का oxidation state = x
- x + 6(-1) = -3
- x – 6 = -3
- x = +3
- उत्तर: Iron का oxidation state +3 है
केस स्टडी प्रश्न (Case Study Based Questions)
केस स्टडी: Cisplatin [Pt(NH₃)₂Cl₂] cancer chemotherapy में widely used drug है। यह DNA के साथ interact करके cancer cells को kill करता है। इसके दो geometrical isomers हैं – cis और trans।
प्रश्न 9:
(a) Cisplatin का IUPAC नाम लिखें।
(b) इसके geometrical isomers के structures draw करें।
(c) क्यों केवल cis isomer biologically active है?
विस्तृत हल:
(a) IUPAC नाम: cis-diamminedichloroplatinum(II)
(b) Structures:
cis isomer: trans isomer:
NH₃ NH₃
| |
Cl-Pt-Cl Cl-Pt-NH₃
| |
NH₃ Cl(c) Biological activity का कारण:
- cis isomer DNA के adjacent bases के साथ simultaneously coordinate कर सकता है
- यह DNA की structure distort कर देता है
- trans isomer में ligands opposite positions में हैं, इसलिए यह DNA cross-linking नहीं कर सकता
आरेख आधारित प्रश्न (Diagram Based Questions)
प्रश्न 10: नीचे दिए गए crystal field splitting diagram को देखकर निम्न प्रश्नों के उत्तर दें:
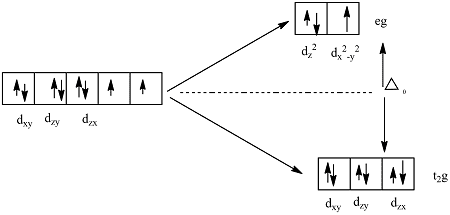
(a) यह कौन सी geometry का diagram है?
(b) t₂g और eg orbitals को identify करें।
(c) d⁶ configuration के लिए high spin और low spin दोनों cases में electron arrangement दिखाएं।
विस्तृत हल:
(a) यह octahedral geometry का crystal field splitting diagram है।
(b)
- t₂g orbitals (lower energy): dxy, dxz, dyz
- eg orbitals (higher energy): dx²-y², dz²
(c) d⁶ configuration:
- High spin (weak field): t₂g⁴ eg² (4 unpaired electrons)
- Low spin (strong field): t₂g⁶ eg⁰ (0 unpaired electrons)
तर्क आधारित प्रश्न (Reasoning Based Questions)
प्रश्न 11: [Ni(CO)₄] diamagnetic है जबकि [NiCl₄]²⁻ paramagnetic है। इसका कारण समझाएं।
विस्तृत हल:
[Ni(CO)₄] का analysis:
- Ni का oxidation state = 0
- Electronic configuration: [Ar] 3d¹⁰ 4s⁰
- सभी d-orbitals filled हैं
- कोई unpaired electrons नहीं → Diamagnetic
[NiCl₄]²⁻ का analysis:
- Ni का oxidation state = +2
- Ni²⁺ configuration: [Ar] 3d⁸
- Cl⁻ weak field ligand → no electron pairing
- Tetrahedral field में 2 unpaired electrons
- Paramagnetic behavior
निष्कर्ष: Oxidation state और ligand field strength दोनों magnetic properties determine करते हैं।
प्रश्न 12: क्यों transition metal complexes colorful होते हैं जबकि main group metal complexes आमतौर पर colorless होते हैं?
विस्तृत हल:
Transition Metal Complexes:
- Partially filled d-orbitals होते हैं
- Ligand field के कारण d-orbitals split हो जाते हैं
- d-d transitions visible light में occur करते हैं
- Specific wavelengths absorb करते हैं → Color दिखता है
Main Group Metal Complexes:
- d-orbitals absent या completely filled होते हैं
- कोई d-d transitions possible नहीं
- UV region में charge transfer transitions हो सकती हैं
- Visible light में कोई absorption नहीं → Colorless
Real-World Connection: यही principle photography, paints, और decorative materials में use होता है।
निष्कर्ष और सफलता की रणनीति (Conclusion and Success Strategy)
समन्वय यौगिक (Coordination Compounds) न केवल CBSE Class 12 Chemistry का एक महत्वपूर्ण अध्याय है बल्कि यह हमारे दैनिक जीवन और आधुनिक विज्ञान से गहराई से जुड़ा हुआ है। हीमोग्लोबिन में oxygen transport से लेकर cancer के इलाज तक, photography से लेकर catalysis में – हर जगह इन अद्भुत यौगिकों का योगदान है।
मुख्य निष्कर्ष (Key Takeaways)
1. अवधारणात्मक समझ सर्वोपरि (Conceptual Understanding is Supreme):
रटकर सीखने के बजाय concepts को समझें। Werner सिद्धांत से शुरू करके step-by-step approach अपनाएं। हर नया topic पिछले concepts पर build होता है।
2. दृश्य शिक्षा की शक्ति (Power of Visual Learning):
3D structures, isomers, और crystal field diagrams को mentally visualize करने की practice करें। यह न केवल समझ बढ़ाता है बल्कि परीक्षा में भी diagram-based questions में मदद करता है।
3. अभ्यास से ही पूर्णता (Practice Makes Perfect):
Nomenclature और isomerism में daily practice आवश्यक है। जितना अधिक practice करेंगे, उतनी ही speed और accuracy बढ़ेगी।
4. Integration की महत्ता (Importance of Integration):
इस chapter को isolated रूप में न पढ़ें। इसे atomic structure, chemical bonding, और d-block elements के साथ connect करें।
सफलता के सूत्र (Success Formula)
समझें + अभ्यास करें + दोहराएं = सफलता
Understanding + Practice + Revision = Success
परीक्षा में उत्कृष्टता के लिए अंतिम सुझाव (Final Tips for Exam Excellence):
सामान्य त्रुटियों से बचाव (Avoiding Common Errors):
- Oxidation state calculation में सावधानी बरतें
- IUPAC naming में alphabetical order follow करें
- Magnetic moment में केवल unpaired electrons count करें
- Isomer identification में systematic approach अपनाएं
भविष्य की राह (Future Prospects)
यह chapter आपको केवल अच्छे marks नहीं दिलाता बल्कि chemistry की advanced fields जैसे कि organometallic chemistry, bioinorganic chemistry, और materials science की नींव भी रखता है। यदि आप engineering, medicine, या research में career बनाना चाहते हैं, तो ये concepts आपके बहुत काम आएंगे।
अंतिम प्रेरणा (Final Motivation):
याद रखें, हर महान chemist एक बार student था। आप भी इन concepts को master कर सकते हैं। जरूरत है तो बस systematic approach, regular practice, और धैर्य की।
“Chemistry is not just about memorizing formulas; it’s about understanding the beautiful dance of atoms and molecules.”
आपकी मेहनत और इस comprehensive guide के साथ, आप निश्चित रूप से Coordination Compounds में अच्छे अंक प्राप्त कर सकेंगे।
यह comprehensive study guide आपको CBSE Class 12 Chemistry के Coordination Compounds chapter में complete mastery प्रदान करने के लिए scientifically designed किया गया है। Regular study, focused practice, और conceptual clarity के साथ आप इस challenging topic को भी अपनी strength बना सकते हैं।
Recommended –
- CBSE Board 2026: The Ultimate Preparation Guide – Study Plan, Time Table, Best Books & Topper Strategies
- कक्षा 12 रसायन विज्ञान अध्याय 3: रासायनिक गतिकी – नोट्स, NCERT समाधान व महत्वपूर्ण प्रश्न (2025-26)
- कक्षा 12 रसायन विज्ञान अध्याय 4: d और f ब्लॉक तत्व(d and f Block Elements) – नोट्स, NCERT समाधान व महत्वपूर्ण प्रश्न (2025-26)

