क्या आपने कभी सोचा है कि जब आप हाथों को सैनिटाइज़ करते हैं तो क्यों वह तुरंत सूख जाता है? या फिर अस्पतालों में इस्तेमाल होने वाली एंटीसेप्टिक की गंध क्यों इतनी तेज़ होती है? इन सभी सवालों का जवाब छुपा है अल्कोहल, फिनोल और ईथर (Alcohols, Phenols, Ethers) के रसायन विज्ञान में!
ये यौगिक सिर्फ किताबों में नहीं हैं – ये हमारे दैनिक जीवन का अभिन्न हिस्सा हैं। इत्र में मिलने वाली मधुर सुगंध से लेकर दवाइयों के निर्माण तक, इन यौगिकों का योगदान अतुलनीय है। आज हम इन जादुई यौगिकों की दुनिया में गहराई से उतरेंगे और समझेंगे कि कैसे एक सामान्य -OH समूह की उपस्थिति पूरे अणु के गुणों को बदल देती है।
यह अध्याय न केवल आपकी बोर्ड परीक्षा के लिए महत्वपूर्ण है, बल्कि यह कार्बनिक रसायन की नींव भी है। जब आप इस अध्याय को पूरा कर लेंगे, तो आप समझ जाएंगे कि क्यों कुछ अल्कोहल पानी में घुल जाते हैं जबकि कुछ नहीं, और क्यों फिनोल अम्लीय प्रकृति दिखाता है।
अध्ययन उद्देश्य (Learning Objectives)
इस अध्याय को पढ़ने के बाद आप सक्षम होंगे:
- संरचना और नामकरण की पूर्ण समझ: अल्कोहल, फिनोल और ईथर की संरचना को पहचानना और IUPAC तथा सामान्य नामकरण प्रणाली के अनुसार नाम देना
- भौतिक गुणों का विश्लेषण: इन यौगिकों के क्वथनांक, गलनांक, घुलनशीलता और अन्य भौतिक गुणों को समझना और उनके कारणों की व्याख्या करना
- रासायनिक अभिक्रियाओं में दक्षता: सभी महत्वपूर्ण रासायनिक अभिक्रियाओं को समझना, उनकी क्रियाविधि लिखना और उत्पादों की भविष्यवाणी करना
- तैयारी की विधियों में निपुणता: विभिन्न प्रयोगशाला और औद्योगिक विधियों से इन यौगिकों की तैयारी करने की समझ
- परीक्षा रणनीति का विकास: बोर्ड परीक्षा के लिए महत्वपूर्ण प्रश्न पैटर्न और उत्तर लेखन तकनीक की पूर्ण जानकारी
- वास्तविक जीवन से जुड़ाव: इन यौगिकों के दैनिक जीवन और औद्योगिक उपयोगों की व्यापक समझ
मूलभूत अवधारणाएं और परिचय (Basic Concepts and Introduction)
हाइड्रॉक्सिल समूह की शक्ति
कल्पना करें कि आपके पास एक साधारण हाइड्रोकार्बन अणु है – जैसे मीथेन (CH₄)। अब यदि इसमें से एक हाइड्रोजन परमाणु को हटाकर -OH समूह (हाइड्रॉक्सिल समूह) लगा दें, तो आपको मिलता है मेथेनॉल (CH₃OH)। यह छोटा सा बदलाव पूरे अणु के व्यवहार को बदल देता है!
यही जादू है हाइड्रॉक्सिल समूह का। यह एक क्रियाशील समूह है जो अणु में ध्रुवीयता लाता है और हाइड्रोजन बंधन बनाने की क्षमता प्रदान करता है।
वर्गीकरण की समझ
अल्कोहल (Alcohols): ये वे यौगिक हैं जिनमें -OH समूह एक संतृप्त कार्बन परमाणु से जुड़ा होता है। जैसे: CH₃CH₂OH (एथेनॉल)
फिनोल (Phenols): यहाँ -OH समूह सीधे बेंजीन रिंग से जुड़ा होता है। जैसे: C₆H₅OH (फिनोल)
ईथर (Ethers): इनमें ऑक्सीजन परमाणु दो कार्बन परमाणुओं के बीच पुल का काम करता है। जैसे: CH₃OCH₃ (डाइमेथिल ईथर)
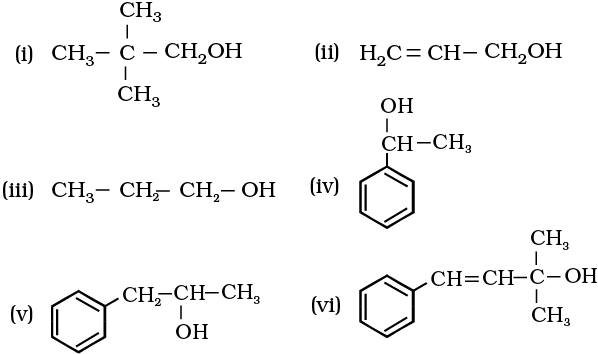
अल्कोहल: संरचना और नामकरण (Alcohols: Structure and Nomenclature)
संरचनात्मक विशेषताएं
अल्कोहल में कार्बन-ऑक्सीजन बंध की लंबाई लगभग 1.43 Å होती है, और O-H बंध की लंबाई 0.96 Å होती है। यह संरचना अल्कोहल को उसके विशिष्ट गुण प्रदान करती है।
नामकरण प्रणाली
IUPAC नामकरण:
- सबसे लंबी कार्बन श्रृंखला चुनें जिसमें -OH समूह हो
- -OH समूह को सबसे कम संख्या दें
- मूल नाम के अंत में ‘-ol’ जोड़ें
उदाहरण:
- CH₃OH → मेथेनॉल
- CH₃CH₂OH → एथेनॉल
- CH₃CH₂CH₂OH → प्रोपान-1-ऑल
- CH₃CH(OH)CH₃ → प्रोपान-2-ऑल
अल्कोहल का वर्गीकरण
प्राथमिक अल्कोहल (1°): -OH समूह प्राथमिक कार्बन से जुड़ा हो
द्वितीयक अल्कोहल (2°): -OH समूह द्वितीयक कार्बन से जुड़ा हो
तृतीयक अल्कोहल (3°): -OH समूह तृतीयक कार्बन से जुड़ा हो
Chemistry Check Box:
प्रश्न: CH₃CH₂CH(OH)CH₂CH₃ में अल्कोहल की श्रेणी क्या है?
उत्तर: यह द्वितीयक अल्कोहल है क्योंकि -OH समूह द्वितीयक कार्बन से जुड़ा है।
फिनोल: संरचना और विशेषताएं (Phenols: Structure and Characteristics)
अनुनाद संरचना की भूमिका
फिनोल की सबसे दिलचस्प बात यह है कि इसमें -OH समूह का अकेला इलेक्ट्रॉन युग्म बेंजीन रिंग के साथ अनुनाद में भाग लेता है। इससे C-O बंध में आंशिक द्विबंध गुण आ जाता है।
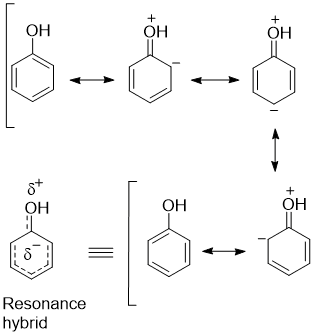
फिनोल की अम्लीय प्रकृति
फिनोल अम्लीय प्रकृति दिखाता है क्योंकि:
- O-H बंध का टूटना आसान हो जाता है
- बनने वाला फिनॉक्साइड आयन अनुनाद द्वारा स्थिर हो जाता है
C₆H₅OH + OH⁻ → C₆H₅O⁻ + H₂O
Common Error Alert:
गलती: अल्कोहल और फिनोल दोनों समान अम्लीयता दिखाते हैं
सही बात: फिनोल अल्कोहल से कहीं अधिक अम्लीय है (pKa ≈ 10) जबकि अल्कोहल बहुत कमजोर अम्लीय है (pKa ≈ 16)
ईथर: संरचना और गुण (Ethers: Structure and Properties)
ईथर की संरचनात्मक विशेषताएं
ईथर में ऑक्सीजन परमाणु sp³ संकरण में होता है, जिससे बंध कोण लगभग 104.5° होता है। यह पानी के समान है लेकिन दो अकेले इलेक्ट्रॉन युग्म की उपस्थिति के कारण इसकी रासायनिक गतिविधि कम होती है।
ईथर का नामकरण
सामान्य नामकरण: दोनों एल्किल समूहों के नाम + ईथर
- CH₃OCH₃ → डाइमेथिल ईथर
- CH₃OCH₂CH₃ → एथिल मेथिल ईथर
IUPAC नामकरण: छोटे एल्किल समूह को एल्कॉक्सी समूह मानकर बड़ी श्रृंखला के साथ नाम दें
- CH₃OCH₂CH₃ → मेथॉक्सीएथेन
भौतिक गुण: तुलनात्मक अध्ययन (Physical Properties: Comparative Study)
क्वथनांक की तुलना
क्रम: अल्कोहल > संगत एल्केन > ईथर
कारण: हाइड्रोजन बंधन की उपस्थिति
उदाहरण:
- एथेनॉल (C₂H₅OH): 78.5°C
- डाइमेथिल ईथर (CH₃OCH₃): -23°C
- एथेन (C₂H₆): -89°C
Real-World Chemistry Callout:
रसोई गैस में प्रोपेन और ब्यूटेन होते हैं, जो कमरे के तापमान पर गैस हैं। लेकिन अगर इनमें -OH समूह जोड़ दें तो ये द्रव बन जाते हैं। यही कारण है कि एथेनॉल कमरे के तापमान पर द्रव है!
घुलनशीलता पैटर्न
पानी में घुलनशीलता का क्रम: छोटे अल्कोहल > फिनोल > ईथर
मुख्य कारक:
- हाइड्रोजन बंधन की क्षमता
- हाइड्रोकार्बन श्रृंखला की लंबाई
- ध्रुवीयता
अल्कोहल श्रृंखला में भौतिक गुणों का परिवर्तन
जैसे-जैसे कार्बन श्रृंखला बढ़ती है:
- क्वथनांक बढ़ता जाता है
- पानी में घुलनशीलता घटती जाती है
- घनत्व बढ़ता जाता है
- श्यानता बढ़ती जाती है
रासायनिक गुण: अल्कोहल की अभिक्रियाएं (Chemical Properties: Reactions of Alcohols)
अम्ल-क्षार अभिक्रियाएं
अल्कोहल बहुत कमजोर अम्ल हैं, लेकिन प्रबल क्षारों से अभिक्रिया करके एल्कॉक्साइड बनाते हैं:
R-OH + Na → R-ONa + ½H₂
प्रयोगात्मक परीक्षण: सोडियम मेटल टेस्ट – अल्कोहल में सोडियम डालने पर हाइड्रोजन गैस निकलती है।
निर्जलीकरण अभिक्रियाएं (Dehydration Reactions)
PROCESS: अल्कोहल का निर्जलीकरण – विस्तृत क्रियाविधि
अंतरअणुक निर्जलीकरण (170°C पर):
R-OH + HO-R → R-O-R + H₂O
अंतराअणविक निर्जलीकरण (180°C पर):
R-CH₂-CH₂-OH → R-CH=CH₂ + H₂O
Saytzeff नियम: निर्जलीकरण में अधिक स्थिर एल्कीन बनता है (अधिक प्रतिस्थापित)
उदाहरण:
CH₃CH₂CH(OH)CH₃ → CH₃CH=CHCH₃ (मुख्य उत्पाद) + CH₃CH₂CH=CH₂ (गौण उत्पाद)
ऑक्सीकरण अभिक्रियाएं
प्राथमिक अल्कोहल का ऑक्सीकरण:
RCH₂OH → RCHO → RCOOH
(एल्डिहाइड → कार्बोक्सिलिक अम्ल)
द्वितीयक अल्कोहल का ऑक्सीकरण:
R₂CHOH → R₂CO
(कीटोन)
तृतीयक अल्कोहल: प्रबल ऑक्सीकारकों के साथ C-C बंध टूटने पर मिश्रित उत्पाद मिलते हैं
ऑक्सीकारक एजेंट:
- PCC (मंद ऑक्सीकरण): प्राथमिक अल्कोहल → एल्डिहाइड
- K₂Cr₂O₇/H₂SO₄ (प्रबल ऑक्सीकरण): पूर्ण ऑक्सीकरण
Chemistry Check Box:
प्रश्न: 2-मेथिलप्रोपान-2-ऑल का ऑक्सीकरण करने पर क्या मिलेगा?
उत्तर: यह तृतीयक अल्कोहल है, इसलिए सामान्य ऑक्सीकरण नहीं होगा। प्रबल परिस्थितियों में C-C बंध टूटकर मिश्रित उत्पाद मिलेंगे।
हैलोजनीकरण अभिक्रियाएं
HX के साथ अभिक्रिया:
R-OH + HX → R-X + H₂O
क्रियाविधि के प्रकार:
- SN1 क्रियाविधि: तृतीयक > द्वितीयक अल्कोहल
- SN2 क्रियाविधि: प्राथमिक अल्कोहल
अभिकर्मकों की तुलना:
- ZnCl₂/HCl (Lucas अभिकर्मक): अल्कोहल की श्रेणी की पहचान के लिए
- SOCl₂: मंद परिस्थितियों में प्रभावी
- PBr₃, PX₃: हैलाइड बनाने के लिए उत्तम
Historical Context Box:
Lucas टेस्ट की खोज Howard Lucas ने 1930 में की थी। यह टेस्ट आज भी प्राथमिक, द्वितीयक और तृतीयक अल्कोहल की पहचान के लिए प्रयोग किया जाता है।
फिनोल की रासायनिक अभिक्रियाएं (Chemical Reactions of Phenols)
इलेक्ट्रोफिलिक प्रतिस्थापन अभिक्रियाएं
फिनोल में -OH समूह एक प्रबल ऑर्थो-पैरा निर्देशक समूह है। यह बेंजीन रिंग को सक्रिय बनाता है।
नाइट्रेशन:
C₆H₅OH + 3HNO₃ → 2,4,6-ट्राइनाइट्रोफिनोल (पिक्रिक अम्ल) + 3H₂O
हैलोजनीकरण:
C₆H₅OH + 3Br₂ → 2,4,6-ट्राइब्रोमोफिनोल + 3HBr
सल्फोनेशन:
C₆H₅OH + H₂SO₄ → p-हाइड्रॉक्सीबेंजीनसल्फोनिक अम्ल
Common Error Alert:
गलती: फिनोल की सभी प्रतिस्थापन अभिक्रियाएं केवल पैरा स्थिति पर होती हैं
सही बात: फिनोल में प्रतिस्थापन मुख्यतः ऑर्थो और पैरा स्थितियों पर होती है, कभी-कभी दोनों स्थितियों पर एक साथ
कोल्बे-श्मिट अभिक्रिया
PROCESS: कोल्बे-श्मिट अभिक्रिया – विस्तृत क्रियाविधि
यह फिनोल से सैलिसिलिक अम्ल बनाने की महत्वपूर्ण अभिक्रिया है:
C₆H₅ONa + CO₂ → सैलिसिलिक अम्ल का सोडियम लवण
(125°C, 4-7 atm दाब पर)
औद्योगिक महत्व: एस्पिरिन (एसिटाइलसैलिसिलिक अम्ल) के निर्माण में प्रयोग
रीमर-टाइमैन अभिक्रिया
CHCl₃ + C₆H₅OH + 3KOH → सैलिसिलएल्डिहाइड
यह अभिक्रिया एल्डिहाइड बनाने के लिए महत्वपूर्ण है।
ईथर की रासायनिक अभिक्रियाएं (Chemical Reactions of Ethers)
अम्लीय माध्यम में विदलन
ईथर सामान्यतः अक्रिय होते हैं, लेकिन प्रबल अम्लों से गर्म करने पर विभाजित हो जाते हैं।
असमान ईथर का विदलन:
R-O-R’ + HI → R-I + R’-OH (छोटा एल्किल समूह)
क्रियाविधि: SN2 (छोटे एल्किल समूह के लिए) या SN1 (बड़े एल्किल समूह के लिए)
फ्राइडल-क्राफ्ट अभिक्रिया
एरिल एल्किल ईथर में एल्किलेशन और एसिलेशन दोनों संभव हैं:
C₆H₅OCH₃ + CH₃COCl → p-CH₃COC₆H₄OCH₃
Process Analysis Sidebar:
- एल्युमिनियम क्लोराइड एसिल क्लोराइड के साथ संकुल बनाता है
- एसिलियम कैटायन (CH₃CO⁺) बनता है
- यह इलेक्ट्रोफिल बेंजीन रिंग पर आक्रमण करता है
- पैरा स्थिति पर प्रतिस्थापन होती है (ऑर्थो स्थिति में स्टेरिक बाधा के कारण)
ऑटो-ऑक्सीकरण
वायु की उपस्थिति में ईथर धीरे-धीरे ऑक्सीकृत होकर विस्फोटक परॉक्साइड बनाते हैं:
R₂CHOCH₂R → R₂C(OOH)OCH₂R
सुरक्षा चेतावनी: प्रयोगशाला में पुराने ईथर का प्रयोग खतरनाक हो सकता है।
तैयारी की विधियां (Methods of Preparation)
अल्कोहल की तैयारी
1. एल्कीन से हाइड्रेशन:
R-CH=CH₂ + H₂O → R-CH₂-CH₂OH (एंटी-मार्कोनिकोव)
H₂SO₄/H₂O → R-CH(OH)-CH₃ (मार्कोनिकोव)
2. कार्बोनिल यौगिकों का अपचयन:
- एल्डिहाइड → प्राथमिक अल्कोहल
- कीटोन → द्वितीयक अल्कोहल
अपचायक एजेंट:
- LiAlH₄ (शुष्क ईथर में)
- NaBH₄ (जलीय माध्यम में)
3. ग्रिग्नार्ड अभिकर्मक से:
RMgX + HCHO → प्राथमिक अल्कोहल
RMgX + R’CHO → द्वितीयक अल्कोहल
RMgX + R’₂CO → तृतीयक अल्कोहल
4. किण्वन विधि:
C₆H₁₂O₆ → 2C₂H₅OH + 2CO₂
(जाइमेज एंजाइम द्वारा)
फिनोल की तैयारी
1. बेंजीनसल्फोनिक अम्ल से:
C₆H₅SO₃H + 2NaOH → C₆H₅OH + Na₂SO₃ + H₂O
(300°C पर)
2. क्यूमीन प्रक्रिया (औद्योगिक):
[PROCESS: क्यूमीन प्रक्रम – चरणबद्ध विवरण]
i) C₆H₅CH₃ + CH₃CH=CH₂ → C₆H₅CH(CH₃)₂ (क्यूमीन)
ii) क्यूमीन + O₂ → क्यूमीन हाइड्रोपरॉक्साइड
iii) क्यूमीन हाइड्रोपरॉक्साइड → C₆H₅OH + (CH₃)₂CO
लाभ: एक साथ फिनोल और एसीटोन दोनों मिलते हैं
3. डायजोनियम लवण से:
C₆H₅N₂⁺Cl⁻ + H₂O → C₆H₅OH + N₂ + HCl
(गर्म करने पर)
ईथर की तैयारी
1. विलियमसन ईथर संश्लेषण:
R-ONa + R’-X → R-O-R’ + NaX
शर्तें: R’-X प्राथमिक हैलाइड होना चाहिए (SN2 क्रियाविधि)
2. अल्कोहल का निर्जलीकरण:
2R-OH → R-O-R + H₂O
(140°C, H₂SO₄)
सीमाएं: केवल समान ईथर बन सकते हैं
3. एल्कीन में एल्कोहल का योग:
R-CH=CH₂ + R’-OH → R-CH(OR’)-CH₃
(अम्लीय माध्यम में)
Real-World Chemistry Callout:
डायइथिल ईथर का प्रयोग सर्जरी में बेहोशी के लिए किया जाता था। आज भी यह प्रयोगशाला में विलायक के रूप में महत्वपूर्ण है, लेकिन आग पकड़ने और परॉक्साइड बनने का खतरा होता है।
औद्योगिक महत्व और उपयोग (Industrial Importance and Uses)
अल्कोहल के उपयोग
एथेनॉल:
- ईंधन के रूप में (गैसोहोल में 10-20%)
- अल्कोहोलिक पेय पदार्थों में
- सॉल्वेंट के रूप में
- एंटीसेप्टिक के रूप में
मेथेनॉल:
- फॉर्मलडिहाइड निर्माण में
- एसिटिक अम्ल निर्माण में
- ईंधन सेल में
- एंटीफ्रीज़ में
Current Research:
वैज्ञानिक अब सेल्यूलोज से एथेनॉल बनाने की तकनीक पर काम कर रहे हैं। यह बायो-फ्यूल का भविष्य हो सकता है और पेट्रोल की निर्भरता कम कर सकता है।
फिनोल के उपयोग
प्लास्टिक निर्माण:
- बेकेलाइट (फिनोल-फॉर्मलडिहाइड रेज़िन)
- मेलामाइन रेज़िन
दवा निर्माण:
- एस्पिरिन (सैलिसिलिक अम्ल से)
- एंटीसेप्टिक्स
- पेनकिलर्स
रसायन उद्योग:
- डाइज़ और पिगमेंट्स
- कीटनाशक
- स्फेनॉलिक रेज़िन
ईथर के उपयोग
डायइथिल ईथर:
- प्रयोगशाला में विलायक
- एनेस्थेटिक (अब कम प्रयोग)
- रसायनिक अभिक्रियाओं में माध्यम
अन्य ईथर:
- ईंधन ऑक्टेन बूस्टर (MTBE)
- दवा उद्योग में
- पॉलिमर उत्पादन में
महत्वपूर्ण रासायनिक परीक्षण (Important Chemical Tests)
अल्कोहल की पहचान के लिए परीक्षण
1. सोडियम टेस्ट:
R-OH + Na → R-ONa + ½H₂
(हाइड्रोजन गैस निकलना)
2. Lucas टेस्ट (ZnCl₂ + HCl):
- तृतीयक अल्कोहल: तुरंत टर्बिडिटी
- द्वितीयक अल्कोहल: 5-10 मिनट में टर्बिडिटी
- प्राथमिक अल्कोहल: गर्म करने पर टर्बिडिटी
3. आयोडोफॉर्म टेस्ट:
CH₃CH(OH)R + I₂ + NaOH → CHI₃ (पीला अवक्षेप)
(द्वितीयक मेथिल अल्कोहल के लिए)
फिनोल की पहचान के लिए परीक्षण
1. FeCl₃ टेस्ट:
C₆H₅OH + FeCl₃ → बैंगनी रंग का कॉम्प्लेक्स
2. ब्रोमीन वाटर टेस्ट:
C₆H₅OH + 3Br₂ → 2,4,6-ट्राइब्रोमोफिनोल (सफेद अवक्षेप)
3. लिबरमैन टेस्ट:
फिनोल + NaNO₂ + H₂SO₄ → लाल रंग
ईथर की पहचान के लिए परीक्षण
1. HI के साथ गर्म करना:
R-O-R’ + 2HI → R-I + R’-I + H₂O
(आयोडीन की गंध)
2. परॉक्साइड टेस्ट:
पुराने ईथर + KI + स्टार्च → नीला रंग
(परॉक्साइड की उपस्थिति)
समस्याओं का समाधान और उदाहरण (Problem Solving and Examples)
संरचना निर्धारण की समस्याएं
उदाहरण 1: आणविक सूत्र C₄H₁₀O वाले यौगिक की सभी संभावित संरचनाएं लिखें।
समाधान:
अल्कोहल:
- CH₃CH₂CH₂CH₂OH (ब्यूटान-1-ऑल)
- CH₃CH₂CH(OH)CH₃ (ब्यूटान-2-ऑल)
- (CH₃)₂CHCH₂OH (2-मेथिलप्रोपान-1-ऑल)
- (CH₃)₃COH (2-मेथिलप्रोपान-2-ऑल)
ईथर:
- CH₃OCH₂CH₂CH₃ (मेथिल प्रोपिल ईथर)
- CH₃CH₂OCH₂CH₃ (डायइथिल ईथर)
- CH₃OCH(CH₃)₂ (आइसोप्रोपिल मेथिल ईथर)
नामकरण की समस्याएं
उदाहरण 2: निम्न यौगिकों के IUPAC नाम लिखें:
a) (CH₃)₂CHCH₂OH
उत्तर: 2-मेथिलप्रोपान-1-ऑल
b) CH₃CH(OH)CH₂CH₂OH
उत्तर: ब्यूटेन-2,4-डाइऑल
c) C₆H₅OCH₃
उत्तर: मेथॉक्सीबेंजीन या एनिसोल
अभिक्रिया की समस्याएं
उदाहरण 3: प्रोपीन से प्रोपान-2-ऑल कैसे बनाएंगे?
समाधान:
CH₃CH=CH₂ + H₂O → CH₃CH(OH)CH₃
(H₂SO₄ की उपस्थिति में, मार्कोनिकोव नियम के अनुसार)
उदाहरण 4: फिनोल से सैलिसिलिक अम्ल बनाने की अभिक्रिया लिखें।
समाधान:
C₆H₅OH + CO₂ → C₆H₄(OH)COOH
(NaOH की उपस्थिति में, 125°C, 4-7 atm दाब पर – कोल्बे-श्मिट अभिक्रिया)
परीक्षा की तैयारी और रणनीति (Exam Preparation and Strategy)
महत्वपूर्ण टॉपिक्स की प्राथमिकता
अत्यधिक महत्वपूर्ण (हमेशा पूछे जाने वाले):
- अल्कोहल का वर्गीकरण और Lucas टेस्ट
- फिनोल की अम्लीय प्रकृति और कारण
- विलियमसन ईथर संश्लेषण
- अल्कोहल की ऑक्सीकरण अभिक्रियाएं
- फिनोल की इलेक्ट्रोफिलिक प्रतिस्थापन
मध्यम महत्वपूर्ण:
- कोल्बे-श्मिट अभिक्रिया
- रीमर-टाइमैन अभिक्रिया
- ईथर का विदलन
- क्यूमीन प्रक्रम
कम महत्वपूर्ण (कभी-कभार पूछे जाने वाले):
- विस्तृत क्रियाविधि
- औद्योगिक प्रक्रम
- नामकरण की जटिल समस्याएं
सामान्य गलतियां और बचाव
Common Error Alert:
1. नामकरण में गलतियां:
- गलत: प्रोपान-1-ऑल को प्रोपेनॉल लिखना
- सही: -OH समूह की स्थिति हमेशा दें
2. अभिक्रिया की शर्तों को भूलना:
- तापमान, दाब, उत्प्रेरक का उल्लेख जरूरी है
- अभिकर्मकों की मात्रा महत्वपूर्ण है
3. संरचना में गलतियां:
- हाइड्रोजन की संख्या गिनना
- बंध कोण और संकरण को गलत समझना
4. क्रियाविधि में गलतियां:
- इलेक्ट्रॉन के प्रवाह की दिशा गलत दिखाना
- इंटरमीडिएट संरचना गलत लिखना
अभ्यास प्रश्न संग्रह (Practice Question Collection)
वस्तुनिष्ठ प्रश्न (MCQs)
प्रश्न 1: निम्नलिखित में से कौन सा यौगिक Lucas अभिकर्मक के साथ तुरंत अभिक्रिया करता है?
a) CH₃CH₂OH
b) CH₃CH₂CH₂OH
c) (CH₃)₃COH
d) CH₃CH(OH)CH₃
उत्तर: c) (CH₃)₃COH
व्याख्या: तृतीयक अल्कोहल Lucas अभिकर्मक के साथ तुरंत अभिक्रिया करके टर्बिडिटी देता है क्योंकि SN1 क्रियाविधि के कारण तृतीयक कार्बोकेटायन स्थिर होता है।
प्रश्न 2: फिनोल अम्लीय प्रकृति दिखाता है क्योंकि:
a) बेंजीन रिंग इलेक्ट्रॉन खींचती है
b) फिनॉक्साइड आयन अनुनाद स्थिरीकृत होता है
c) O-H बंध कमजोर होता है
d) उपरोक्त सभी
उत्तर: d) उपरोक्त सभी
व्याख्या: बेंजीन रिंग का इलेक्ट्रॉन खींचने वाला प्रभाव O-H बंध को कमजोर करता है, और बनने वाला फिनॉक्साइड आयन अनुनाद द्वारा स्थिर हो जाता है।
प्रश्न 3: विलियमसन ईथर संश्लेषण में निम्न में से कौन सी अभिक्रिया होती है?
a) SN1
b) SN2
c) E1
d) E2
उत्तर: b) SN2
व्याख्या: विलियमसन ईथर संश्लेषण में एल्कॉक्साइड आयन प्राथमिक हैलाइड पर SN2 क्रियाविधि से आक्रमण करता है।
प्रश्न 4: निम्न में से कौन सा अभिकर्मक प्राथमिक अल्कोहल को एल्डिहाइड में ऑक्सीकृत करता है?
a) K₂Cr₂O₇/H₂SO₄
b) PCC
c) KMnO₄
d) सभी
उत्तर: b) PCC
व्याख्या: PCC (पाइरिडीनियम क्लोरोक्रोमेट) मंद ऑक्सीकारक है जो प्राथमिक अल्कोहल को एल्डिहाइड तक ही ऑक्सीकृत करता है, जबकि अन्य प्रबल ऑक्सीकारक कार्बोक्सिलिक अम्ल तक ऑक्सीकृत कर देते हैं।
प्रश्न 5: कोल्बे-श्मिट अभिक्रिया में फिनोल किसके साथ अभिक्रिया करता है?
a) CO
b) CO₂
c) COCl₂
d) CH₃COCl
उत्तर: b) CO₂
व्याख्या: कोल्बे-श्मिट अभिक्रिया में सोडियम फिनॉक्साइड CO₂ के साथ अभिक्रिया करके सैलिसिलिक अम्ल का सोडियम लवण बनाता है।
संख्यात्मक प्रश्न
प्रश्न 6: 25°C पर एथेनॉल का वाष्प दाब 44.5 mmHg है। यदि एथेनॉल के 23 g को 27 g पानी में घोला जाए तो मिश्रण का वाष्प दाब ज्ञात करें। (पानी का वाष्प दाब 25°C पर 23.8 mmHg है)
समाधान:
Step 1: मोलों की गणना
- एथेनॉल के मोल = 23/46 = 0.5 mol
- पानी के मोल = 27/18 = 1.5 mol
- कुल मोल = 0.5 + 1.5 = 2.0 mol
Step 2: मोल अंश की गणना
- एथेनॉल का मोल अंश (X₁) = 0.5/2.0 = 0.25
- पानी का मोल अंश (X₂) = 1.5/2.0 = 0.75
Step 3: राउल्ट के नियम का प्रयोग
P = P₁°X₁ + P₂°X₂
P = (44.5 × 0.25) + (23.8 × 0.75)
P = 11.125 + 17.85 = 28.975 mmHg
उत्तर: 29.0 mmHg
केस स्टडी आधारित प्रश्न
प्रश्न 7: एक अज्ञात यौगिक A का आणविक सूत्र C₃H₈O है। यह निम्नलिखित अभिक्रियाएं देता है:
- सोडियम के साथ H₂ गैस निकालता है
- Lucas अभिकर्मक के साथ 5 मिनट में टर्बिडिटी देता है
- आयोडोफॉर्म टेस्ट पॉजिटिव है
- PCC के साथ ऑक्सीकरण पर कीटोन बनता है
यौगिक A की पहचान करें और सभी अभिक्रियाओं की व्याख्या करें।
समाधान:
यौगिक A की पहचान: CH₃CH(OH)CH₃ (प्रोपान-2-ऑल)
अभिक्रियाओं की व्याख्या:
- सोडियम टेस्ट:
CH₃CH(OH)CH₃ + Na → CH₃CH(ONa)CH₃ + ½H₂
(अल्कोहल की पुष्टि) - Lucas टेस्ट:
5 मिनट में टर्बिडिटी = द्वितीयक अल्कोहल की पुष्टि - आयोडोफॉर्म टेस्ट:
CH₃CH(OH)CH₃ + I₂ + NaOH → CHI₃ + CH₃COONa
(द्वितीयक मेथिल अल्कोहल की पुष्टि) - PCC ऑक्सीकरण:
CH₃CH(OH)CH₃ + PCC → CH₃COCH₃ (एसीटोन)
(द्वितीयक अल्कोहल कीटोन देता है)
आरेख आधारित प्रश्न
प्रश्न 8: निम्नलिखित प्रक्रम का नामांकित आरेख बनाएं और समझाएं:
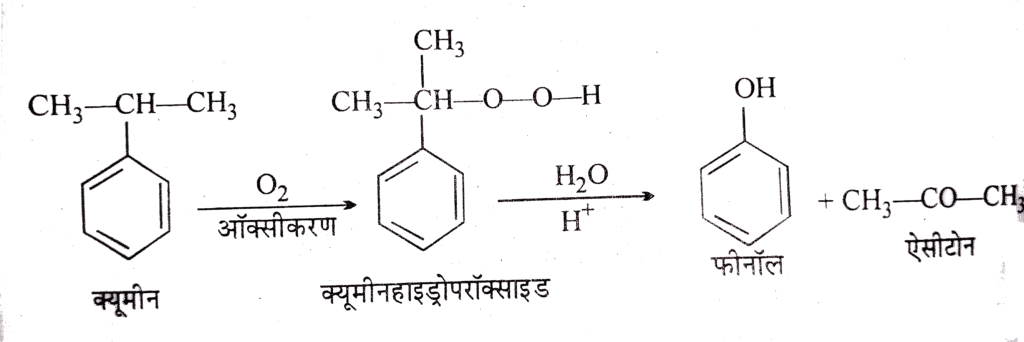
प्रक्रम की व्याख्या:
चरण 1: एल्किलेशन
C₆H₅CH₃ + (CH₃)₂C=CH₂ → C₆H₅CH(CH₃)₂
(AlCl₃ उत्प्रेरक, 250°C)
चरण 2: ऑक्सीकरण
C₆H₅CH(CH₃)₂ + O₂ → C₆H₅C(CH₃)₂OOH
(95-135°C, वायुमंडलीय दाब)
चरण 3: अम्लीय विघटन
C₆H₅C(CH₃)₂OOH + H₂SO₄ → C₆H₅OH + (CH₃)₂CO
(60-65°C)
औद्योगिक लाभ:
- एक साथ दो महत्वपूर्ण उत्पाद मिलते हैं
- उच्च उत्पादन दर
- पर्यावरण अनुकूल प्रक्रम
तर्क आधारित प्रश्न
प्रश्न 9: निम्नलिखित कथनों की तर्कसंगत व्याख्या करें:
a) एथेनॉल पानी में पूर्णतः मिश्रणीय है जबकि डाइइथिल ईथर केवल थोड़ा घुलता है।
b) फिनोल का क्वथनांक टॉल्यूईन से अधिक है।
c) तृतीयक अल्कोहल सामान्य ऑक्सीकरण नहीं दर्शाते।
उत्तर:
a) घुलनशीलता में अंतर:
- एथेनॉल में -OH समूह की उपस्थिति के कारण पानी के साथ प्रबल हाइड्रोजन बंधन बनता है
- डाइइथिल ईथर में हाइड्रोजन बंधन दाता समूह नहीं है, केवल स्वीकर्ता है
- इसलिए एथेनॉल पानी में पूर्णतः घुलता है जबकि ईथर सीमित रूप से
b) क्वथनांक में अंतर:
- फिनोल में अंतराअणविक हाइड्रोजन बंधन होता है जबकि टॉल्यूईन में नहीं
- हाइड्रोजन बंधन तोड़ने के लिए अतिरिक्त ऊर्जा चाहिए
- इसलिए फिनोल का क्वथनांक (182°C) टॉल्यूईन (111°C) से अधिक है
c) तृतीयक अल्कोहल का ऑक्सीकरण:
- ऑक्सीकरण के लिए α-हाइड्रोजन की आवश्यकता होती है
- तृतीयक अल्कोहल में α-कार्बन पर कोई हाइड्रोजन नहीं होता
- इसलिए सामान्य ऑक्सीकरण असंभव है
- प्रबल परिस्थितियों में C-C बंध टूटकर मिश्रित उत्पाद बनते हैं
महत्वपूर्ण सूत्र और स्मरण तकनीक (Important Formulas and Memory Techniques)
मुख्य सूत्र
राउल्ट का नियम:
P = P₁°X₁ + P₂°X₂ + … (आदर्श विलयन के लिए)
हेनरी का नियम:
P = KₕX (गैसों की घुलनशीलता के लिए)
वाष्प दाब अवनमन:
ΔP = P°X₂ (जहाँ X₂ विलेय का मोल अंश है)
स्मरण तकनीक
अल्कोहल की श्रेणी याद रखने के लिए:
“प्राथमिक = 1 रिप्लेसमेंट, द्वितीयक = 2 रिप्लेसमेंट, तृतीयक = 3 रिप्लेसमेंट”
ऑक्सीकरण उत्पाद याद रखने के लिए:
“प्राथमिक → एल्डिहाइड → अम्ल”
“द्वितीयक → कीटोन (रुक जाता है)”
“तृतीयक → कोई ऑक्सीकरण नहीं”
फिनोल के परीक्षण के लिए:
“FeCl₃ = बैंगनी, Br₂ = सफेद अवक्षेप, NaNO₂ = लाल”
विलियमसन ईथर संश्लेषण के लिए:
“छोटा हैलाइड + बड़ा एल्कॉक्साइड = बेहतर परिणाम”
निष्कर्ष और परीक्षा रणनीति (Conclusion and Exam Strategy)
मुख्य सीख
अल्कोहल, फिनोल और ईथर का अध्ययन करने के बाद हमने देखा कि कैसे एक छोटा सा -OH समूह पूरे अणु के गुणों को बदल देता है। यह अध्याय न केवल कार्बनिक रसायन की नींव है बल्कि दैनिक जीवन से भी गहरा जुड़ाव रखता है।
मुख्य बिंदु:
- संरचना और गुणों के बीच सीधा संबंध है
- हाइड्रोजन बंधन इन यौगिकों के भौतिक गुणों को निर्धारित करता है
- अनुनाद प्रभाव फिनोल की अम्लीयता का कारण है
- क्रियाविधि की समझ अभिक्रियाओं को समझने में मदद करती है
सफलता के सुझाव
नियमित अभ्यास: रोज़ाना कम से कम 5 अभिक्रियाएं लिखें
अवधारणा की स्पष्टता: रटकर नहीं, समझकर पढ़ें
प्रायोगिक कार्य: यदि संभव हो तो प्रयोगशाला के काम को ध्यान से देखें
समूह चर्चा: दोस्तों के साथ कठिन विषयों पर चर्चा करें
भविष्य की पढ़ाई के लिए दिशा
यह अध्याय आपको आगे के अध्यायों के लिए तैयार करता है:
- एल्डिहाइड और कीटोन: ऑक्सीकरण अभिक्रियाओं की समझ काम आएगी
- कार्बोक्सिलिक अम्ल: फिनोल की अम्लीयता की समझ उपयोगी होगी
- बायोमॉलेक्यूल्स: अल्कोहल और ईथर लिंकेज की जानकारी जरूरी है
प्रेरणादायक संदेश
रसायन विज्ञान सिर्फ सूत्रों और अभिक्रियाओं का संग्रह नहीं है – यह प्रकृति की भाषा है। जब आप एक अल्कोहल अणु की संरचना समझते हैं, तो आप वास्तव में समझ रहे हैं कि प्रकृति कैसे काम करती है। यह ज्ञान न केवल आपकी परीक्षा में मदद करेगा बल्कि आपको एक बेहतर वैज्ञानिक भी बनाएगा।
“रसायन वह विज्ञान है जो असंभव को संभव बनाता है। आज का असंभव कल की खोज है।”
अंतिम शब्द
इस संपूर्ण अध्ययन गाइड के साथ आप पूरी तरह से तैयार हैं। याद रखें कि सफलता धैर्य, अभ्यास और दृढ़ता से मिलती है। अपने ऊपर विश्वास रखें और अपना सर्वश्रेष्ठ दें।
Recommended –
- CBSE Board 2026: The Ultimate Preparation Guide – Study Plan, Time Table, Best Books & Topper Strategies
- कक्षा 12 रसायन विज्ञान अध्याय 5: समन्वय यौगिक – नोट्स, NCERT समाधान व महत्वपूर्ण प्रश्न (2025-26)
- कक्षा 12 रसायन विज्ञान अध्याय 6: हैलोऐल्केन और हैलोएरीन – नोट्स, NCERT समाधान व महत्वपूर्ण प्रश्न (2025-26)

