क्या आपने कभी सोचा है कि आपके मोबाइल फोन की बैटरी कैसे काम करती है? या फिर चांदी की चेन पर सोने का लेप कैसे चढ़ाया जाता है? जब लोहे पर जंग लगती है तो वास्तव में क्या होता है? इन सभी रोजमर्रा की घटनाओं के पीछे विद्युत रसायन (Electrochemistry) का सिद्धांत काम कर रहा है।
विद्युत रसायन रसायन विज्ञान की वह शाखा है जो रासायनिक अभिक्रियाओं और विद्युत ऊर्जा के बीच संबंध का अध्ययन करती है। यह हमारे दैनिक जीवन से इतना जुड़ा हुआ है कि आधुनिक तकनीक इसके बिना अधूरी है। कार की बैटरी से लेकर इलेक्ट्रोप्लेटिंग तक, पानी के विद्युत अपघटन से लेकर कोरोजन प्रोटेक्शन तक – सभी जगह विद्युत रसायन के सिद्धांत काम आते हैं।
CBSE कक्षा 12 में यह यूनिट न केवल बोर्ड परीक्षा की दृष्टि से महत्वपूर्ण है बल्कि JEE और NEET जैसी प्रतियोगी परीक्षाओं में भी इसका विशेष महत्व है। इस गाइड में हम आपको सरल भाषा में, व्यावहारिक उदाहरणों के साथ विद्युत रसायन की संपूर्ण जानकारी देंगे।
सीखने के उद्देश्य (Learning Objectives)
इस अध्याय को पूरा करने के बाद आप निम्नलिखित में सक्षम होंगे:
- गैल्वैनिक सेल और इलेक्ट्रोलिटिक सेल की संरचना और कार्यप्रणाली को समझना
- मानक इलेक्ट्रोड विभव की गणना करना और सेल EMF निकालना
- नर्न्स्ट समीकरण का उपयोग करके विभिन्न परिस्थितियों में सेल विभव की गणना करना
- विद्युत अपघटन की प्रक्रिया और फैराडे के नियमों को समझना
- चालकता और मोलर चालकता की अवधारणा और इनकी गणना करना
- बैटरी, ईंधन सेल और कोरोजन जैसे व्यावहारिक अनुप्रयोगों को समझना
मुख्य अवधारणाएं (Main Concepts)
1. विद्युत रासायनिक सेल का परिचय (Introduction to Electrochemical Cells)
विद्युत रासायनिक सेल एक ऐसी व्यवस्था है जहाँ रासायनिक ऊर्जा को विद्युत ऊर्जा में बदला जाता है या इसके विपरीत। इसे समझने के लिए आइए एक सरल उदाहरण लेते हैं।
कल्पना करिए कि आपके पास जिंक की एक छड़ और कॉपर की एक छड़ है। अगर आप इन्हें अलग-अलग घोलों में डालकर एक तार से जोड़ देते हैं, तो विद्युत धारा प्रवाहित होने लगती है। यही विद्युत रासायनिक सेल का सिद्धांत है।
विद्युत रासायनिक सेल के प्रकार:
गैल्वैनिक सेल (Galvanic Cell): इसमें रासायनिक ऊर्जा विद्युत ऊर्जा में बदलती है। आपकी घड़ी या मोबाइल की बैटरी गैल्वैनिक सेल का उदाहरण है।
इलेक्ट्रोलिटिक सेल (Electrolytic Cell): इसमें विद्युत ऊर्जा का उपयोग करके रासायनिक अभिक्रिया कराई जाती है। इलेक्ट्रोप्लेटिंग इसका सबसे अच्छा उदाहरण है।
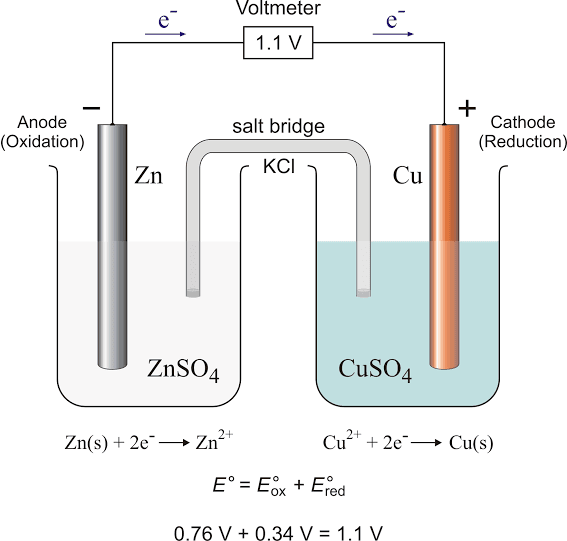
Common Error Alert: अनेक छात्र गैल्वैनिक और इलेक्ट्रोलिटिक सेल में कैथोड और एनोड को लेकर भ्रम में रहते हैं। याद रखिए:
- गैल्वैनिक सेल में: एनोड ऋणात्मक, कैथोड धनात्मक
- इलेक्ट्रोलिटिक सेल में: एनोड धनात्मक, कैथोड ऋणात्मक
2. इलेक्ट्रोड विभव और सेल विभव (Electrode Potential and Cell Potential)
जब कोई धातु अपने आयनों के घोल में डाली जाती है, तो इलेक्ट्रोड और घोल के बीच एक विभवांतर स्थापित हो जाता है। इसे इलेक्ट्रोड विभव कहते हैं।
मानक इलेक्ट्रोड विभव (Standard Electrode Potential):
- तापमान: 298K (25°C)
- दबाव: 1 atm
- सांद्रता: 1M
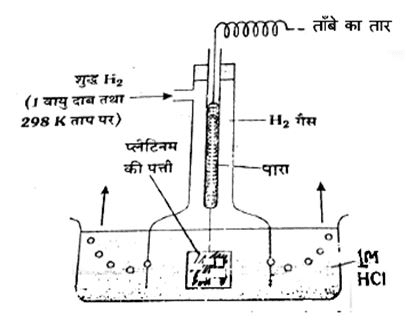
मानक हाइड्रोजन इलेक्ट्रोड (Standard Hydrogen Electrode – SHE):
इसे सभी इलेक्ट्रोडों के विभव मापने का आधार माना गया है और इसका विभव शून्य माना गया है।
सेल विभव की गणना:
E°cell = E°cathode – E°anode
Chemistry Check:
यदि Zn²⁺/Zn का E° = -0.76V है और Cu²⁺/Cu का E° = +0.34V है, तो Zn-Cu सेल का EMF क्या होगा?
उत्तर: E°cell = 0.34 – (-0.76) = 1.10V
3. नर्न्स्ट समीकरण (Nernst Equation)
वास्तविक परिस्थितियों में इलेक्ट्रोड विभव मानक अवस्था से अलग होता है। नर्न्स्ट समीकरण इस स्थिति में सेल विभव की गणना करने में मदद करती है।
नर्न्स्ट समीकरण:
E = E° - (RT/nF) ln Qया
E = E° - (0.0591/n) log Q (298K पर)जहाँ:
- E = वास्तविक सेल विभव
- E° = मानक सेल विभव
- R = गैस स्थिरांक (8.314 J/mol·K)
- T = तापमान (K में)
- n = अभिक्रिया में स्थानांतरित इलेक्ट्रॉनों की संख्या
- F = फैराडे स्थिरांक (96500 C/mol)
- Q = अभिक्रिया भागफल
Real-World Chemistry:
आपकी कार की बैटरी में भी नर्न्स्ट समीकरण काम करती है। जैसे-जैसे बैटरी discharge होती है, अभिक्रिया भागफल (Q) बदलता रहता है और इसलिए बैटरी का विभव भी कम होता जाता है।
PROCESS: नर्न्स्ट समीकरण का उपयोग – Step by Step
- अभिक्रिया को balanced form में लिखें
- इलेक्ट्रॉनों की संख्या (n) निकालें
- अभिक्रिया भागफल (Q) की गणना करें
- नर्न्स्ट समीकरण में मान रखकर E की गणना करें
अभ्यास प्रश्न:
एक सेल में अभिक्रिया Zn + Cu²⁺ → Zn²⁺ + Cu होती है। यदि [Zn²⁺] = 0.1M और [Cu²⁺] = 0.01M है, तो 298K पर सेल विभव की गणना करें। (E°cell = 1.10V)
हल:
Q = [Zn²⁺]/[Cu²⁺] = 0.1/0.01 = 10
n = 2
E = 1.10 – (0.0591/2) log 10
E = 1.10 – (0.0591/2) × 1
E = 1.10 – 0.02955 = 1.07V
4. चालकता और मोलर चालकता (Conductivity and Molar Conductivity)
विद्युत अपघट्य घोलों में आयनों की उपस्थिति के कारण विद्युत चालकता होती है। यह समझना महत्वपूर्ण है कि कैसे सांद्रता चालकता को प्रभावित करती है।
चालकता (Conductivity – κ):
- इकाई: S/m या S/cm
- प्रतिरोधकता का व्युत्क्रम
- κ = 1/ρ
मोलर चालकता (Molar Conductivity – Λm):
Λm = κ × 1000/Cजहाँ C = मोलरता (mol/L में)
कोल्राउश का नियम (Kohlrausch’s Law):
अनंत तनुता पर किसी विद्युत अपघट्य की मोलर चालकता उसके आयनों की चालकताओं के योग के बराबर होती है।
Λ°m = λ⁺ + λ⁻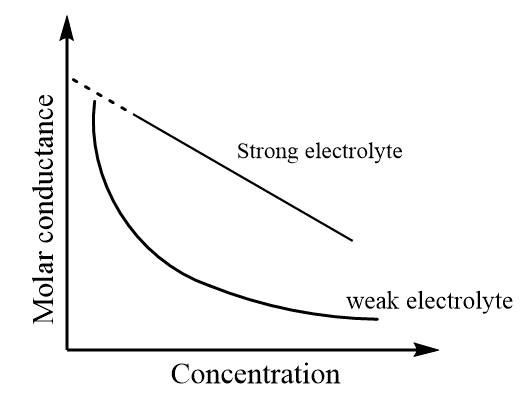
Historical Context:
फ्रेडरिक कोल्राउश (Friedrich Kohlrausch) ने 1876 में यह नियम दिया था। उन्होंने पाया कि कमजोर और मजबूत विद्युत अपघट्यों की चालकता अलग-अलग तरीके से सांद्रता पर निर्भर करती है।
कमजोर विद्युत अपघट्यों के लिए:
α = Λm/Λ°m (विकारणता गुणांक)
अभ्यास प्रश्न:
0.1M NaCl घोल की चालकता 1.06 × 10⁻² S/m है। इसकी मोलर चालकता की गणना करें।
हल:
Λm = κ × 1000/C
Λm = 1.06 × 10⁻² × 1000/0.1
Λm = 106 S·cm²/mol
5. विद्युत अपघटन (Electrolysis)
विद्युत अपघटन वह प्रक्रिया है जिसमें विद्युत धारा प्रवाहित करके रासायनिक अभिक्रिया कराई जाती है। यह प्रक्रिया उद्योगों में व्यापक रूप से उपयोग होती है।
फैराडे के विद्युत अपघटन नियम:
प्रथम नियम:
विद्युत अपघटन में मुक्त होने वाले पदार्थ का द्रव्यमान प्रवाहित आवेश के समानुपाती होता है।
m = Z × I × tजहाँ Z = विद्युत रासायनिक तुल्यांक
द्वितीय नियम:
जब समान आवेश विभिन्न विद्युत अपघट्यों से प्रवाहित किया जाता है, तो मुक्त होने वाले पदार्थों के द्रव्यमान उनके रासायनिक तुल्यांकों के समानुपाती होते हैं।
PROCESS: विद्युत अपघटन की गणना – विस्तृत विधि
- अभिक्रिया लिखें और इलेक्ट्रॉनों की संख्या निकालें
- आवेश की गणना करें (Q = I × t)
- फैराडे स्थिरांक का उपयोग करके मोल निकालें
- मोलर द्रव्यमान से गुणा करके द्रव्यमान निकालें
Current Research:
आजकल water splitting (पानी का विद्युत अपघटन) हाइड्रोजन ईंधन बनाने के लिए बहुत महत्वपूर्ण है। यह clean energy का एक मुख्य स्रोत बन सकता है।
अभ्यास प्रश्न:
2A धारा 30 मिनट तक CuSO₄ के घोल से प्रवाहित की जाती है। कैथोड पर जमा होने वाले Cu का द्रव्यमान निकालें।
हल:
Cu²⁺ + 2e⁻ → Cu
Q = I × t = 2 × 30 × 60 = 3600 C
मोल = Q/(n × F) = 3600/(2 × 96500) = 0.0186 mol
द्रव्यमान = 0.0186 × 63.5 = 1.18 g
6. बैटरी और ईंधन सेल (Batteries and Fuel Cells)
बैटरी हमारे दैनिक जीवन का अभिन्न अंग है। आइए समझते हैं कि विभिन्न प्रकार की बैटरियां कैसे काम करती हैं।
प्राथमिक सेल (Primary Cells):
ये एक बार उपयोग होने वाली बैटरी हैं।
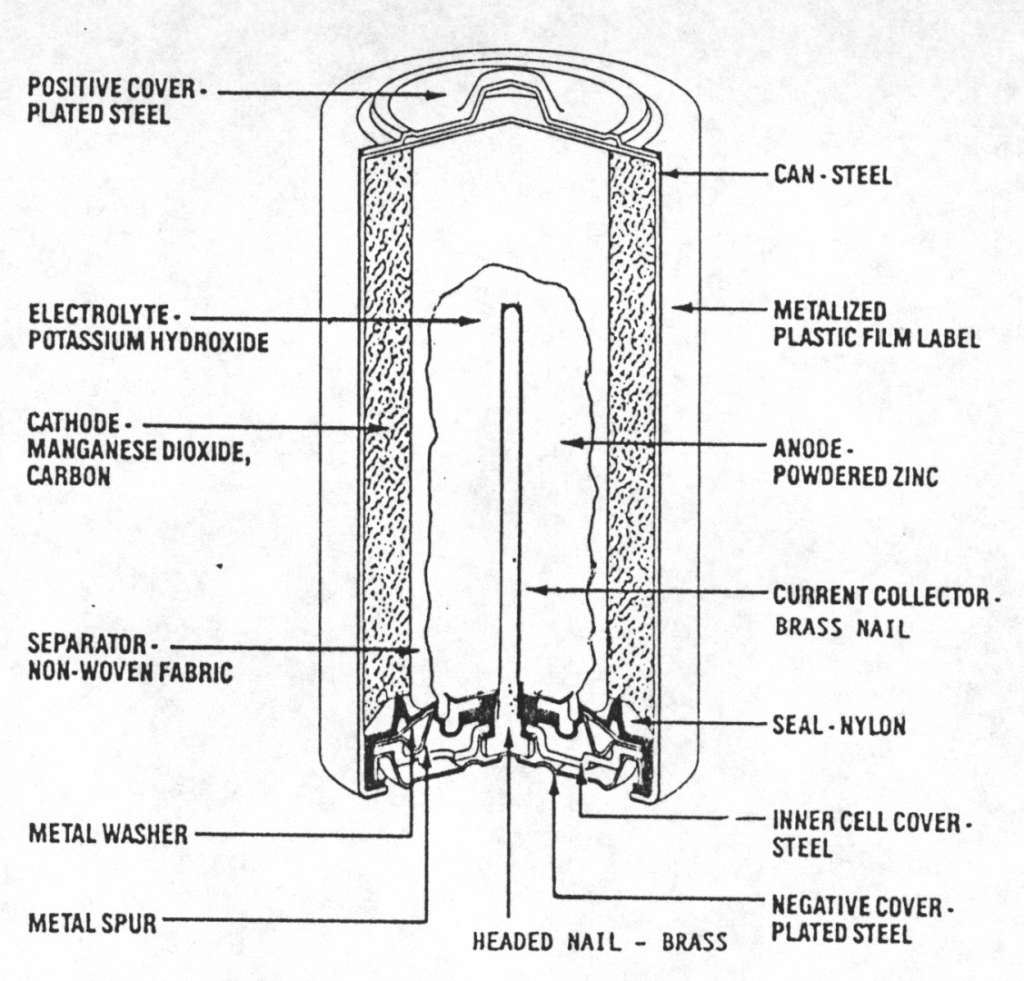
लेक्लांशे सेल (Dry Cell):
- एनोड: Zn
- कैथोड: MnO₂ + C
- अभिक्रिया: Zn + 2MnO₂ + 2NH₄Cl → [Zn(NH₃)₂]Cl₂ + Mn₂O₃ + H₂O
द्वितीयक सेल (Secondary Cells):
ये रिचार्जेबल बैटरी हैं।
लेड एसिड बैटरी:
- एनोड: Pb
- कैथोड: PbO₂
- इलेक्ट्रोलाइट: H₂SO₄
डिस्चार्जिंग के दौरान:
एनोड पर: Pb + SO₄²⁻ → PbSO₄ + 2e⁻
कैथोड पर: PbO₂ + 4H⁺ + SO₄²⁻ + 2e⁻ → PbSO₄ + 2H₂O
ईंधन सेल (Fuel Cells):
H₂-O₂ ईंधन सेल में:
एनोड पर: 2H₂ + 4OH⁻ → 4H₂O + 4e⁻
कैथोड पर: O₂ + 2H₂O + 4e⁻ → 4OH⁻
Real-World Chemistry:
Tesla की कारों में लिथियम-आयन बैटरी का उपयोग होता है। इसमें Li⁺ आयन एनोड से कैथोड की ओर गति करते हैं। यह बैटरी हजारों बार रिचार्ज हो सकती है।
7. कोरोजन और इसकी रोकथाम (Corrosion and Its Prevention)
कोरोजन एक अवांछित विद्युत रासायनिक प्रक्रिया है जो धातुओं को नुकसान पहुंचाती है। लोहे पर जंग लगना इसका सबसे आम उदाहरण है।
लोहे पर जंग लगने की प्रक्रिया:
एनोड पर: 2Fe → 2Fe²⁺ + 4e⁻
कैथोड पर: O₂ + 4H⁺ + 4e⁻ → 2H₂O
समग्र अभिक्रिया: 2Fe + O₂ + 4H⁺ → 2Fe²⁺ + 2H₂O
Fe²⁺ आगे ऑक्सीकृत होकर Fe₂O₃·xH₂O (जंग) बनाता है।
कोरोजन की रोकथाम:
- गैल्वेनाइजेशन: लोहे पर जिंक की परत चढ़ाना
- इलेक्ट्रोप्लेटिंग: अन्य धातुओं की सुरक्षात्मक परत
- कैथोडिक सुरक्षा: अधिक सक्रिय धातु को जोड़ना
- पेंट और तेल: ऑक्सीजन और नमी से बचाव
Process Analysis: गैल्वेनाइजेशन की प्रक्रिया
- लोहे की सतह की सफाई
- जिंक के घोल में डुबाना या जिंक का spray करना
- जिंक परत का formation
- जिंक की sacrifice होकर लोहे की सुरक्षा
Common Error Alert:
अनेक छात्र समझते हैं कि गैल्वेनाइजेशन में जिंक केवल barrier का काम करता है। वास्तव में जिंक एक sacrificial anode का काम करता है और पहले ऑक्सीकृत होता है।
8. महत्वपूर्ण सूत्र और संबंध (Important Formulas and Relations)
मुख्य सूत्र:
- नर्न्स्ट समीकरण:
E = E° – (0.0591/n) log Q - चालकता:
κ = 1/ρ
Λm = κ × 1000/C - फैराडे नियम:
m = (I × t × M)/(n × F) - सेल विभव:
E°cell = E°cathode – E°anode - गिब्स ऊर्जा:
ΔG° = -nFE° - साम्य स्थिरांक:
log K = nE°/0.0591
स्मृति सहायक (Mnemonics):
- OIL RIG: Oxidation Is Loss (of electrons), Reduction Is Gain
- RED CAT: REDuction at CAThode
- AN OX: ANode is where OXidation occurs
9. व्यावहारिक अनुप्रयोग (Practical Applications)
औद्योगिक उपयोग:
- इलेक्ट्रोप्लेटिंग: गहनों पर सोने की परत, कारों के parts पर क्रोमियम प्लेटिंग
- इलेक्ट्रोरिफाइनिंग: अशुद्ध धातुओं का शुद्धीकरण
- इलेक्ट्रोविनिंग: अयस्कों से धातुओं का निष्कर्षण
पर्यावरणीय अनुप्रयोग:
- वेस्ट वाटर ट्रीटमेंट: विद्युत अपघटन से पानी की सफाई
- क्लोर-अल्काली उद्योग: NaCl के विद्युत अपघटन से Cl₂, H₂, और NaOH का उत्पादन
ऊर्जा भंडारण:
- लिथियम-आयन बैटरी: मोबाइल, लैपटॉप, इलेक्ट्रिक व्हीकल
- सुपरकैपेसिटर: त्वरित चार्जिंग के लिए
- फ्लो बैटरी: बड़े पैमाने पर ऊर्जा भंडारण
10. समस्या समाधान रणनीति (Problem Solving Strategy)
विद्युत रसायन की समस्याओं को हल करने के चरण:
- समस्या का विश्लेषण: क्या दिया गया है और क्या निकालना है
- अभिक्रिया लिखना: balanced chemical equation
- उपयुक्त सूत्र चुनना: नर्न्स्ट, फैराडे आदि
- इकाइयों की जांच: सभी quantities में सही units
- गणना: step-by-step calculation
- उत्तर की जांच: क्या यह reasonable है?
विभिन्न प्रकार के प्रश्न:
Type 1: EMF गणना
- मानक विभव दिए हों तो सीधे घटाना
- सांद्रता दी हो तो नर्न्स्ट equation का उपयोग
Type 2: विद्युत अपघटन
- हमेशा balanced equation से शुरू करें
- फैराडे constant का सही उपयोग करें
Type 3: चालकता समस्याएं
- इकाइयों पर विशेष ध्यान दें
- मोलरता और normality में भ्रम न करें
अभ्यास प्रश्न (Practice Questions)
बहुविकल्पीय प्रश्न (Multiple Choice Questions)
प्रश्न 1: मानक हाइड्रोजन इलेक्ट्रोड का विभव होता है:
(a) +1.0 V
(b) 0.0 V
(c) -1.0 V
(d) +0.76 V
उत्तर: (b) 0.0 V
व्याख्या: SHE को सभी इलेक्ट्रोडों के विभव मापने का आधार माना गया है और इसका विभव शून्य निर्धारित किया गया है।
प्रश्न 2: फैराडे स्थिरांक का मान है:
(a) 96485 C/mol
(b) 96500 C/mol
(c) 6.022 × 10²³
(d) 8.314 J/mol·K
उत्तर: (a) 96485 C/mol (व्यावहारिक गणना में 96500 का उपयोग करते हैं)
प्रश्न 3: गैल्वैनिक सेल में:
(a) विद्युत ऊर्जा रासायनिक ऊर्जा में बदलती है
(b) रासायनिक ऊर्जा विद्युत ऊर्जा में बदलती है
(c) कोई ऊर्जा परिवर्तन नहीं होता
(d) केवल heat energy निकलती है
उत्तर: (b) रासायनिक ऊर्जा विद्युत ऊर्जा में बदलती है
संख्यात्मक प्रश्न (Numerical Problems)
प्रश्न 4:
एक Cu²⁺/Cu इलेक्ट्रोड में Cu²⁺ की सांद्रता 0.1 M है। इस इलेक्ट्रोड का विभव निकालें। (E°Cu²⁺/Cu = +0.34 V)
हल:
Cu²⁺ + 2e⁻ → Cu
नर्न्स्ट समीकरण: E = E° – (0.0591/n) log(1/[Cu²⁺])
E = 0.34 – (0.0591/2) log(1/0.1)
E = 0.34 – (0.0591/2) log(10)
E = 0.34 – (0.0591/2) × 1
E = 0.34 – 0.02955 = 0.310 V
प्रश्न 5:
2.5 A धारा 20 मिनट तक AgNO₃ के घोल से प्रवाहित की जाती है। कैथोड पर जमा होने वाले Ag का द्रव्यमान निकालें।
हल:
Ag⁺ + e⁻ → Ag
Q = I × t = 2.5 × 20 × 60 = 3000 C
मोल = Q/(n × F) = 3000/(1 × 96500) = 0.0311 mol
द्रव्यमान = 0.0311 × 108 = 3.36 g
केस स्टडी आधारित प्रश्न (Case Study Questions)
केस स्टडी 1: कार की बैटरी
राम की कार की बैटरी खराब हो गई है। बैटरी में लेड-एसिड का उपयोग होता है। इसमें एनोड के रूप में Pb और कैथोड के रूप में PbO₂ का उपयोग होता है। इलेक्ट्रोलाइट के रूप में H₂SO₄ का उपयोग होता है।
प्रश्न (i): डिस्चार्जिंग के दौरान एनोड पर होने वाली अभिक्रिया लिखें।
उत्तर: Pb + SO₄²⁻ → PbSO₄ + 2e⁻
प्रश्न (ii): इस बैटरी को रिचार्ज क्यों किया जा सकता है?
उत्तर: क्योंकि डिस्चार्जिंग के दौरान बनने वाले उत्पाद (PbSO₄) चार्जिंग के दौरान वापस मूल पदार्थों में बदल जाते हैं।
आरेख आधारित प्रश्न (Diagram Based Questions)
प्रश्न 6:
एक गैल्वैनिक सेल का आरेख बनाएं जिसमें Zn|Zn²⁺ और Cu|Cu²⁺ half cells हों। इसमें salt bridge की भूमिका समझाएं।
उत्तर:
[आरेख में दिखाना चाहिए: Zn rod in ZnSO₄ solution, Cu rod in CuSO₄ solution, salt bridge connecting both, external circuit with electron flow]
Salt Bridge की भूमिका:
- इलेक्ट्रिकल न्यूट्रैलिटी बनाए रखना
- Circuit को complete करना
- Diffusion potential को कम करना
तर्क आधारित प्रश्न (Reasoning Questions)
प्रश्न 7: क्यों गैल्वैनिक सेल में EMF समय के साथ कम होता जाता है?
उत्तर:
- अभिक्रिया के चलते reactants की सांद्रता कम होती जाती है
- Products की सांद्रता बढ़ती जाती है
- नर्न्स्ट समीकरण के अनुसार Q का मान बढ़ता है
- इसलिए E का मान कम होता जाता है
प्रश्न 8: इलेक्ट्रोप्लेटिंग में object को कैथोड क्यों बनाया जाता है?
उत्तर:
- कैथोड पर reduction होती है
- Metal ions इलेक्ट्रॉन पाकर metal में बदल जाते हैं
- यह metal object की सतह पर जम जाता है
- इस प्रकार uniform coating मिलती है
परीक्षा रणनीति और युक्तियां (Exam Strategy and Tips)
महत्वपूर्ण टॉपिक्स की प्राथमिकता
उच्च प्राथमिकता (High Priority):
- नर्न्स्ट समीकरण और इसके अनुप्रयोग
- फैराडे के नियम और संख्यात्मक प्रश्न
- इलेक्ट्रोड विभव की गणना
- चालकता और मोलर चालकता
मध्यम प्राथमिकता (Medium Priority):
- बैटरी के प्रकार और कार्यप्रणाली
- कोरोजन और रोकथाम
- इलेक्ट्रोलिसिस के व्यावहारिक अनुप्रयोग
सामान्य अध्ययन:
- ऐतिहासिक तथ्य
- उद्योगों में उपयोग
- पर्यावरणीय प्रभाव
सामान्य गलतियों से बचाव
गणना में गलतियां:
- इकाइयों का गलत उपयोग: हमेशा SI units में convert करें
- फैराडे constant: 96500 का उपयोग करें, 96485 नहीं
- log और ln की गलती: Calculator में सही function दबाएं
अवधारणा की गलतियां:
- Anode-Cathode confusion: हमेशा सेल के type के अनुसार decide करें
- EMF calculation: हमेशा (Cathode – Anode) करें
- Nernst equation: Q में concentration का सही ratio लिखें
लेखन गलतियां:
- Chemical equations: हमेशा balanced लिखें
- Units: उत्तर के साथ proper units लिखें
- Significant figures: Given data के अनुसार answer दें
निष्कर्ष (Conclusion)
विद्युत रसायन केवल एक academic subject नहीं है, बल्कि यह हमारे दैनिक जीवन से गहराई से जुड़ा हुआ है। आपके smartphone की battery से लेकर electric vehicles तक, renewable energy storage से लेकर water purification तक – हर जगह विद्युत रसायन के सिद्धांत काम कर रहे हैं।
भविष्य की संभावनाएं:
विद्युत रसायन में career opportunities बढ़ रही हैं। Battery technology, fuel cells, electroplating industry, water treatment, और renewable energy sectors में विशेषज्ञों की मांग है।
अंतिम सुझाव:
- नियमित अभ्यास करें – रोज कम से कम 2-3 numerical problems solve करें
- Conceptual clarity पर focus करें – rote learning से बचें
- Real-world connections बनाएं – theory को practical examples के साथ जोड़ें
- Past papers solve करें – exam pattern की समझ के लिए
- Group study करें – difficult concepts को discuss करें
याद रखिए, विद्युत रसायन में success का मंत्र है: समझना → अभ्यास करना → Apply करना। जब आप concepts को सिर्फ याद नहीं करते बल्कि समझते हैं, तो आप किसी भी प्रकार के प्रश्न को solve कर सकते हैं।
इस guide को regularly refer करें, practice problems solve करते रहें, और हमें पूरा विश्वास है कि आप CBSE Class 12 Chemistry में excellent performance दे सकेंगे।
Success tip: अपना एक personal formula sheet बनाएं जिसमें सभी important formulas, constants, और key points हों। परीक्षा से पहले सिर्फ इसी sheet को देखें।
All the best for your CBSE Class 12 Chemistry examination! आपकी मेहनत और इस comprehensive guide के साथ, आप निश्चित रूप से अपने लक्ष्य को प्राप्त करेंगे।
यह study guide CBSE के latest syllabus और examination pattern के अनुसार तैयार की गई है। नियमित updates के लिए अपने solvefy AI के संपर्क में रहें।
Recommended –

